OncoPROSTATE Dx – Test de diagnòstic per càncer de pròstata
Visió general
OncoPROSTATE Dx és una solució innovadora, no invasiva, precisa, rendible i validada, especialment desenvolupada per ajudar en el diagnòstic del càncer de pròstata així com per a la confirmació de la mateixa ―com a complement a troballes sospitoses obtingudes mitjançant procediments de diagnòstic per la imatge, per tal de reduir el nombre de biòpsies de teixit innecessàries a les que els pacients s’han de sotmetre―. També té usos potencials per a la monitorització del tractament, pronòstic i per a la vigilància davant recidives.
OncoPROSTATE Dx calcula el risc a partir d’una puntuació que s’obté de diversos biomarcadors del pacient (principalment marcadors tumorals així com de certa informació clínica del mateix).

Click here to download the brochure in PDF format.
Marcadors tumorals
Els marcadors tumorals són substàncies alliberades per les cèl·lules tumorals, que entren al torrent sanguini o altres fluids biològics i són útils per al diagnòstic, pronòstic i monitorització del tractament en diferents tipus de càncer.
La majoria dels marcadors tumorals no són específics de cap tipus de càncer i les diferències entre les malalties benignes i malignes són quantitatives (per exemple, els pacients amb tumors epitelials tendeixen a tenir nivells significativament més alts d’aquests marcadors tumorals que els pacients sense malignitat).
En l’actualitat, existeixen més de 20 paràmetres ben coneguts que són àmpliament considerats com a marcadors de tumors, com el PSA ―relacionat amb el càncer de pròstata―, el CA 15.3 ―relacionat amb el càncer de mama―, el CA 125 i la HE4 ―tots dos relacionats amb càncer de ovari―, el CEA i el CA 19.9 ―ambdós relacionats amb diferents tipus de càncer gastrointestinal (càncer colorectal, gàstric i pancreàtic)―, o la NSE i la ProGRP ―ambdues relacionats amb el càncer de pulmó―.
No obstant això, hi ha una varietat de factors que poden afectar l’exactitud dels marcadors tumorals ja que fan augmentar els seus nivells sense presència de malignitat. La raó principal són les malalties benignes, encara que també poden afectar diferents interferències tècniques.
En aquest sentit, la Societat Espanyola de Bioquímica Clínica i Patologia Molecular, Comissió de Biomarcadors del Càncer, va establir els Criteris Barcelona, 4 criteris que busquen ajudar a distingir i valorar correctament els resultats dels marcadors tumorals i reduir el nombre de falsos positius (FP):
- Avaluació de les concentracions sèriques dels marcadors tumorals.
- Descartar patologies benignes com a principal font de falsos positius.
- Recomanació de seguiment si els marcadors tumorals llancen resultats moderats (Zona Gris/Indeterminat).
- Eliminació d’interferències tècniques.
Mesures estadístiques en proves de diagnòstic
Desafortunadament, l’ús de marcadors tumorals en la rutina presenta també altres problemes, com ara baixa sensibilitat en etapes primerenques o inexistència d’un marcador tumoral específic per a cada tumor maligne. No obstant això, la combinació de 2 o més marcadors tumorals llança millors resultats, especialment en etapes avançades.
En aquest sentit, la combinació de diversos marcadors tumorals ―així com la inclusió d’informació de la història clínica del pacient en els càlculs―, utilitzant algoritmes complexos amb múltiples variables, dóna com a resultat una major sensibilitat i especificitat: això és el que hem batejat com MBDAA (de l’anglès, Multiple Biomarkers Disease Activity Algorithms).
La sensibilitat d’un test de diagnòstic és el percentatge de positius reals que s’identifiquen correctament, i l’especificitat és la proporció de negatius veritables que es classifiquen correctament. Les dues variables estan estretament unides entre si i donen una idea de l’exactitud d’aquest test.
Un test que identifiqui correctament tots els veritables positius com positius, però que tingui molts falsos negatius tindria una sensibilitat del 100%, però una baixa especificitat. Per exemple, la sensibilitat mesura el nombre de tumors malignes que s’identifiquen correctament com càncer, mentre que l’especificitat mesura el nombre de tumors no malignes que s’identifiquen correctament com benignes. Una alta sensibilitat significa menys càncers diagnosticats com benignes i una alta especificitat significa menys tumors benignes diagnosticats com malignes.
A més, el valor predictiu positiu (VPP) és el nombre de veritables positius correctament identificats sobre el total de positius reals. Una prova amb molts falsos positius tindrà un VPP baix. D’altra banda, el valor predictiu negatiu (VPN) és el nombre de negatius veritables correctament identificats sobre el total de negatius reals. Un alt valor VPN vol dir que molt pocs positius veritables van ser incorrectament identificats com negatius.
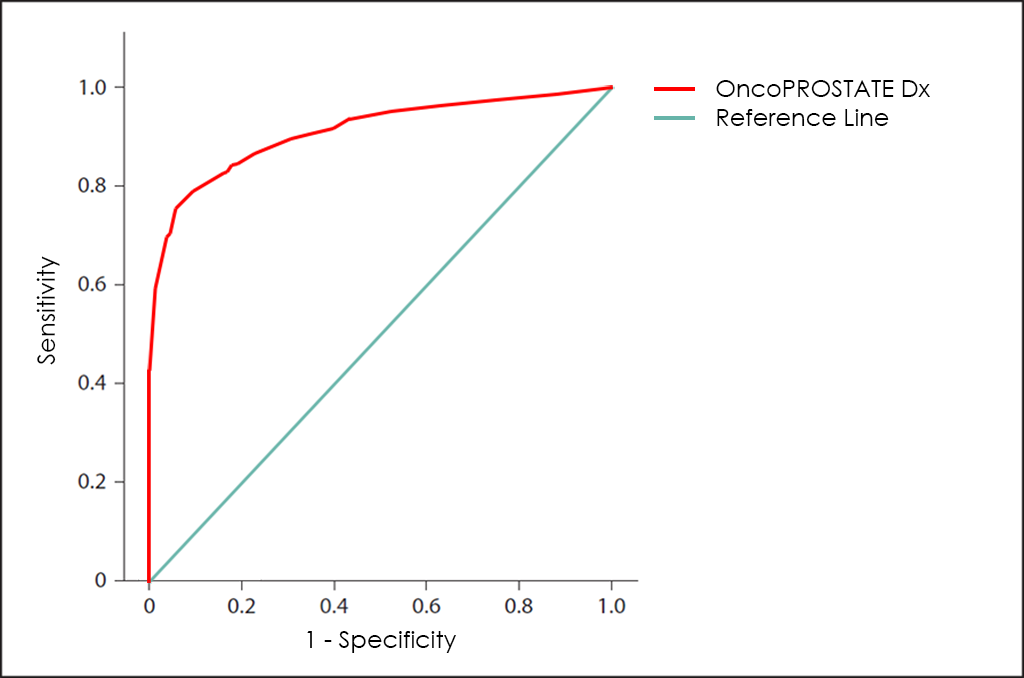
Tots aquests paràmetres diferents es poden representar junts en un gràfic que es coneix com a corba ROC (de l’anglès, Receiving Operator Curve), on es mostren millors resultats amb corbes que tendeixen a acostar-se a la cantonada superior esquerra de la imatge (100% de sensibilitat i 100% d’especificitat).
Corba ROC
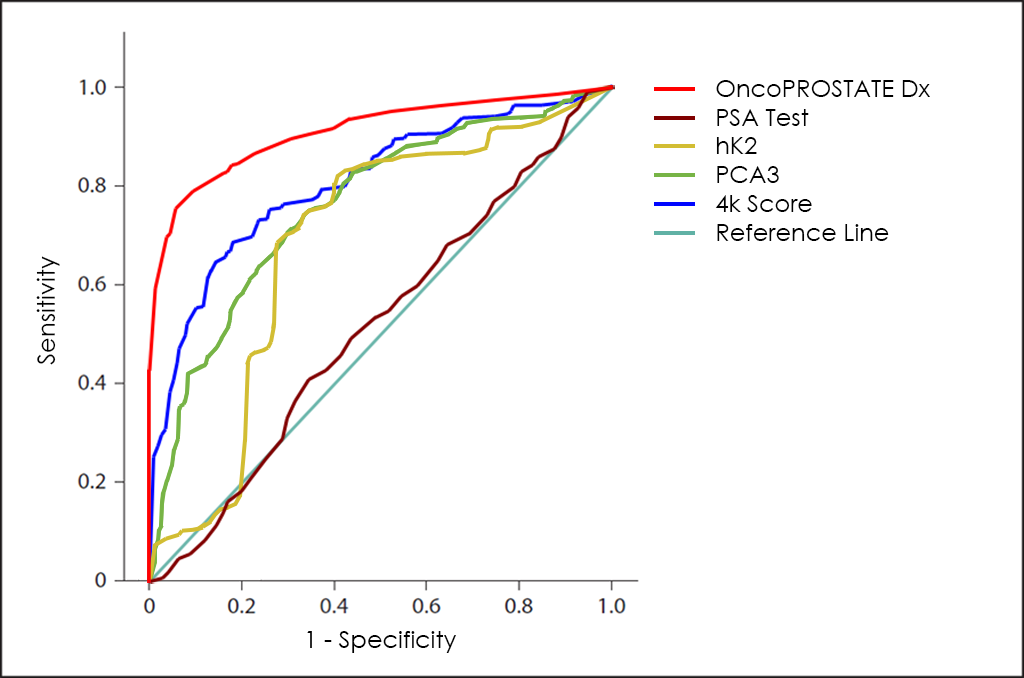
La corba ROC del test OncoPROSTATE Dx ―basat en el recompte combinat dels marcadors tumorals PSA total, PSA lliure (fPSA), p2PSA i hK2; la sobreexpressió dels gens Post-DRE PCA3 i T2:ERG; diferents comorbiditats, així com altres dades de 3.725 pacients―, mostra unes capacitats de diagnòstic realment interessants: 81,7% de sensibilitat i 98,2% d’especificitat.
Com funciona
Com tots els tests MBDAA de BIOPROGNOS, OncoPROSTATE Dx està disponible online a través d’un accés segur a la nostra plataforma Cloud. Com a solució al núvol, OncoPROSTATE Dx està dissenyat per ser utilitzat en modalitat Software as a Service (SaaS), és a dir, sense instal·lació, sense actualitzacions periòdiques, amb baix cost total d’adquisició, així com sense costos de manteniment.
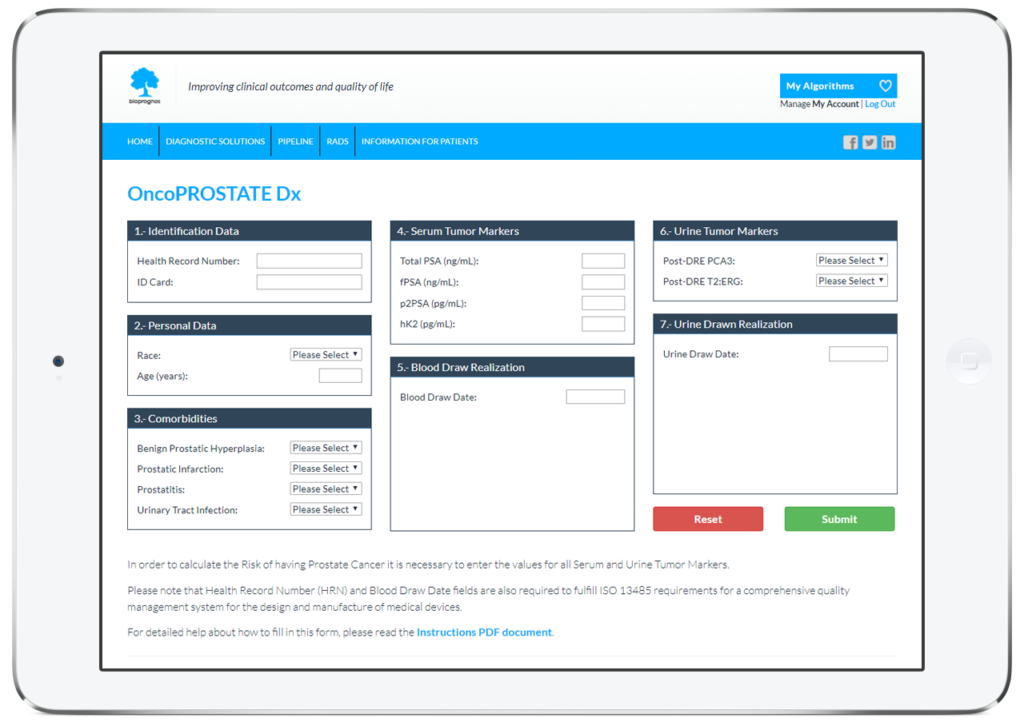
D’aquesta manera, els doctors o els tècnics de laboratori tan sols han d’omplir el formulari online amb els valors obtinguts prèviament dels pacients (dades personals, comorbiditats i valors dels marcadors tumorals) i prémer en el botó Enviar per obtenir el risc de tenir càncer de pròstata.
Fulls de comanda
Per facilitar la feina, els doctors poden descarregar-se i omplir el formulari de comanda del test OncoPROSTATE Dx d’una manera ràpida i fàcil ―amb totes les dades necessàries per a un càlcul òptim del risc ja detallats―.

Premi aquí per descarregar-se el full de comanda d’OncoPROSTATE Dx en format PDF.
Informe final
Després que els doctors introdueixin les dades del pacient en el formulari online, l’aplicació presenta els resultats en una pantalla separada, permetent la seva conversió a document PDF per descarregar o enviar per correu electrònic.


Premi aquí per descarregar-se l’informe en format PDF.
L’informe inclou dues seccions principals: Informació del pacient i Resultat. En la primera es mostren totes les dades del pacient introduïdes prèviament per al seu seguiment. La segona inclou: Resultats, que indiquen si els nivells dels marcadors tumorals estan dins del rang de normalitat o no; Risc, amb una barra de puntuació que mostra la probabilitat de tenir càncer de pròstata; Comentaris, creats dinàmicament per ajudar els doctors i als professionals de la salut a entendre d’una manera fàcil com s’han detectat falsos positius (com nivells de marcadors tumorals sospitosos de presència de càncer, però que en considerar les altres variables en conjunt, no es corresponen amb troballes malignes); i, finalment, les Conclusions, amb recomanacions que suggereixen la presència de càncer, repetir el test en 4 setmanes (pel risc moderat, és a dir, aquells casos en què els nivells dels marcadors tumorals són superiors a la normalitat però en els que no està clar ser d’alt risc), o repetir el test en 1 any per als resultats de baix risc.
Cal tenir en compte que l’informe final està orientat tan sols per a professionals de la salut ―no per pacients―, ja que OncoPROSTATE Dx ha estat dissenyat com “una eina per ajudar els professionals de la salut en el diagnòstic de càncer de pròstata”, i certificat amb aquesta finalitat per la DECLARACIÓ DE CONFORMITAT CE (Directiva de Dispositius Metges 93/42/CEE, Classe I, Regla 12).
Declaració de conformitat CE
Des del passat 20 d’abril de 2017 (quan es va llançar la versió 1.0), OncoPROSTATE Dx posseeix la Declaració de conformitat CE que certifica que ha estat avaluat per complir amb alts requisits de seguretat, salut i protecció ambiental.

Premi aquí per descarregar-se la DECLARACIÓ DE CONFORMITAT CE d’OncoPROSTATE Dx en format PDF.
Aquesta declaració certifica la prova OncoPROSTATE Dx per tot l’Espai Econòmic Europeu (EEE).
A més, també hi ha altres dos avantatges importants que atorga el marcatge CE, tant a les empreses com als consumidors en l’EEE:
- Les empreses tenen la garantia que els productes que disposen del marcatge CE poden comercialitzar-se a tot l’EEE.
- Els consumidors tenen la garantia que es disposa del mateix nivell de salut, seguretat i protecció mediambiental en tot l’EEE.
Altres tests disponibles
Des de fa anys, s’utilitzen diferents mètodes per al diagnòstic precoç del càncer de pròstata, incloent l’ús del marcador tumoral PSA, però els resultats no són satisfactoris, ja que aquest marcador té una baixa sensibilitat en les primeres etapes, a més de presentar una elevada proporció de falsos positius ―independentment de l’edat del pacient―.
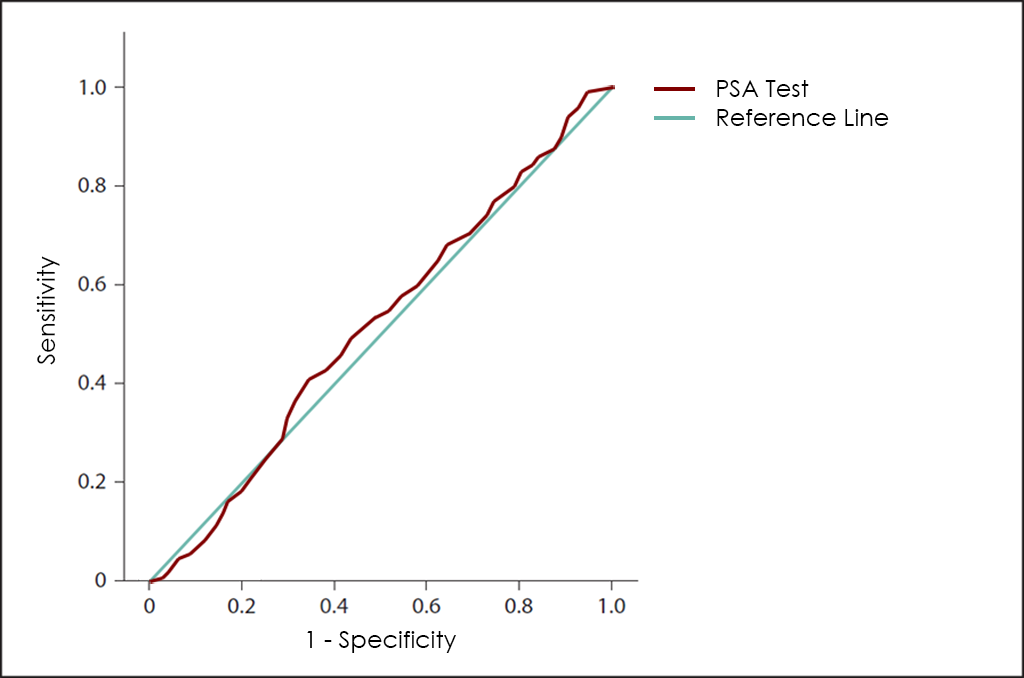
El PSA té papers ben definits en el càncer de pròstata (incloent el diagnòstic, l’estadificació, la planificació i la resposta al tractament), però, els clínics han de recordar que el PSA és més aviat “òrgan específic” més que “tumor específic “.
A més, els nivells de PSA ajustats per edat així com la ràtio PSA lliure/PSA total tan sols s’han de considerar com una simple orientació i requereixen de més exploracions complementàries. Per exemple, el paper de la ràtio PSA lliure/PSA total (els carcinomes presenten nivells més elevats de PSA total que de PSA lliure), en la determinació de la causa d’un nivell elevat de PSA, només pot prevenir aquelles biòpsies en els casos on es té la certesa que no hi ha carcinoma, una cosa gairebé improbable amb aquests mètodes. D’altra banda, també és important remarcar que, la realització d’un examen rectal posterior a la determinació dels nivells de PSA en sang, tampoc és un mètode que es pugui considerar recomanable per descartar resultats falsament elevats.
En aquest sentit, com més sol·licituds del test PSA es realitzin, major serà la probabilitat de trobar nivells fora del rang de normalitat (0-4 ng/ml), de manera que les diferents societats oncològiques de tot el món recomanen utilitzar aquest mètode en el seu context correcte o en cas contrari hi ha el risc de crear ansietat al associar-se un increment dels seus nivells amb el càncer de pròstata ―una cosa que lamentablement ha passat amb més freqüència de la desitjada, sobretot quan els nivells de PSA estan just per sobre de 4 ng/ml―. A més, el punt de tall absolut utilitzat per determinar la necessitat de realitzar una biòpsia de pròstata no està clar i les taxes de detecció en nivells de PSA entre 2,5-4,0 ng/ml han demostrat ser semblants (al voltant del 30%) a les taxes per nivells entre 4,0-10,0 ng/ml. Això indica que valors entre 2-2,5 ng/ml podrien ser un punt de tall més apropiat que 4,0 ng/ml. En contra d’això, alguns experts recomanen la necessitat urgent d’utilitzar altres marcadors tumorals que reflecteixin més exactament la malignitat.
En els últims anys, l’estudi d’altres nous marcadors tumorals, bàsicament isoformes del PSA com ara el p2PSA o PSA Intacte (iPSA), han ajudat a aconseguir una major sensibilitat per a les primeres etapes, així com una major especificitat per a tots els estadis, però sense resultats que puguin recomanar el seu ús com a solució única de diagnòstic.
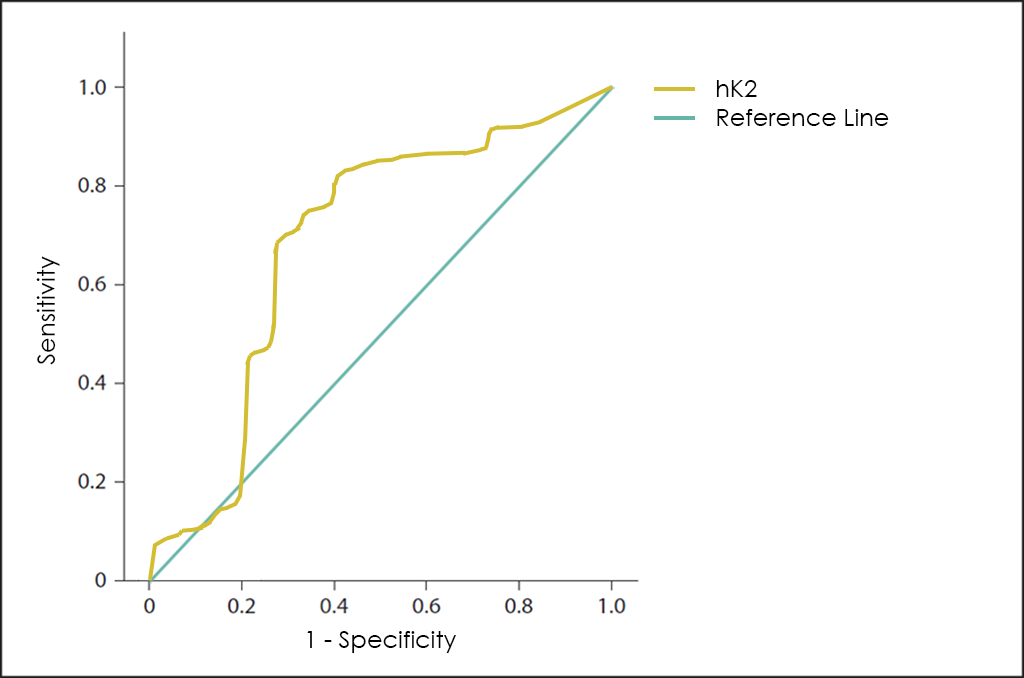
Un altre marcador tumoral interessant és el hK2, que encara que pertany a la mateixa família de proteases sèriques que el PSA ―compartint fins al 80% de les seves seqüències de aminoàcids―, sembla diferenciar millor entre benignitat (hiperplàsia benigna de pròstata o prostatitis, entre d’altres) i malignitat, que el mateix PSA.
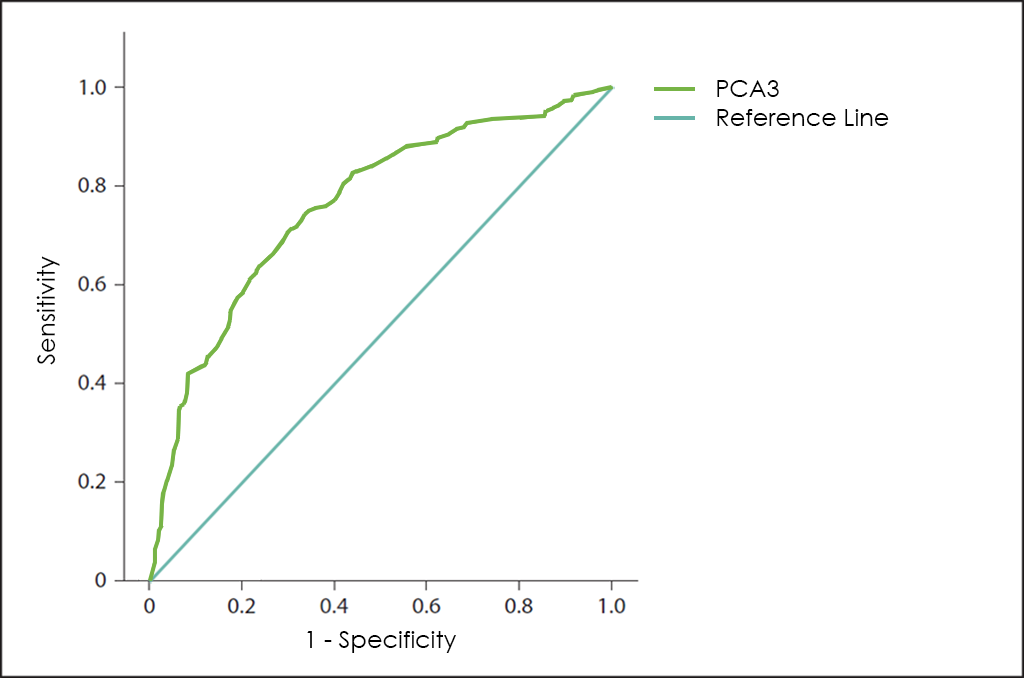
Posterioment es va descobrir el marcador tumoral PCA3 (de l’anglès, Prostate Cancer Antigen 3). EL PCA3 és un gen que expressa ARN no codificant que només s’expressa en el teixit prostàtic humà amb nivells molt elevats davant la presència de càncer de pròstata (fins a 60 o 100 vegades més en les cèl·lules cancerígenes que en les cèl·lules sanes), pel qual, a causa del seu perfil d’expressió restringit, l’ARN del PCA3 s’ha considerat útil com a marcador tumoral per al diagnòstic del càncer de pròstata. Lamentablement, si es fa servir de forma independentment ―com mostra la seva corba ROC―, no té prou sensibilitat i especificitat davant la malignitat que permeti descartar la presència de càncer per si mateix.
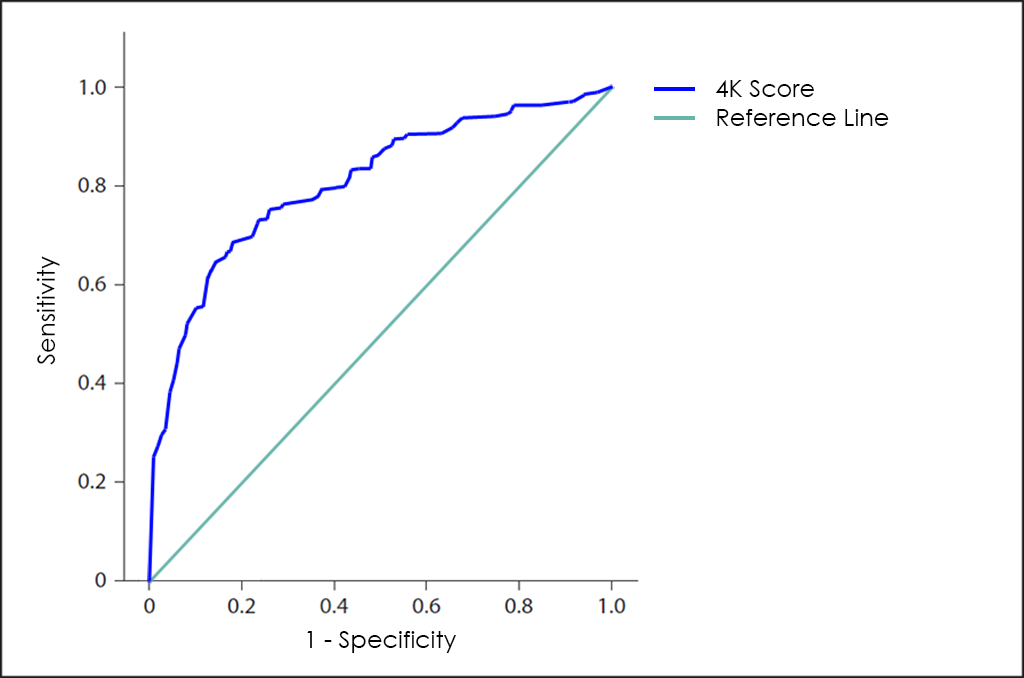
D’altra banda, Opko Health (Nasdaq: OPK), una empresa nord-americana de biotecnologia, va desenvolupar el 4K Score amb la intenció d’ajudar els doctors a prendre les decisions de tractament adequades per als pacients amb glàndula prostàtica augmentada o nivells elevats de PSA, intentant reduir les biòpsies innecessàries de pròstata típiques per falsos positius.
El 4K Score es basa en els nivells en sang de 4 calicreínas (PSA total, fPSA, IPSA i hK2), sent el seu rendiment global més gran que el test PSA, però massa pobre també com per considerar-lo com a mètode de diagnòstic més enllà que la simple orientació ―al presentar encara una elevada taxa de falsos positius―.
Per finalitzar, la superposició de les corbes ROC del test PSA, dels marcadors tumorals hK2 i PCA3, del 4k Score, així com el nostre test OncoPROSTATE Dx.
Usos i propòsits d’OncoPROSTATE Dx
OncoPROSTATE Dx ha estat desenvolupat per:
- Ajuda en avaluacions diagnòstiques per pacients d’alt risc (homes majors de 50 anys amb nivells sanguinis de PSA superiors a 4 ng/ml).
- Confirmar o descartar malignitat en resultats obtinguts anteriorment amb altres proves, com ara tomografia computada (TC) o imatges de ressonància magnètica (IRM), gràcies a una major sensibilitat i especificitat que els procediments d’imatge.
- Ajudar als doctors a predir el comportament del càncer i la seva resposta al tractament, així com les possibilitats de recuperació d’una persona.
- Guiar en les decisions de tractament (ajudar a decidir si s’ha d’afegir immunoteràpia després de la cirurgia i/o radioteràpia); monitorització de la teràpia (els doctors poden usar els canvis en la presència o quantitat d’un o més marcadors tumorals per avaluar com el càncer està responent al tractament); així com predir o monitoritzar possibles recidives (la detecció de canvis en els valors dels marcadors tumorals en controls seriats pot ser part del pla de seguiment, el que pot ajudar a detectar una recurrència abans que altres mètodes).
La ciència darrera d’OncoPROSTATE Dx
Investigacions de referència
- Salami S. S., Schmidt F., Laxman B., Regan M. M., Rickman D. S., Scherr D., Bueti G., Siddiqui J., Tomlins S. A., Wei J. T., Chinnaiyan A, Rubin M. A., Sanda M. G. “Combining Urinary Detection of TMPRSS2:ERG and PCA3 with Serum PSA to Predict Diagnosis of Prostate Cancer.” Urol Oncol. 2013 July ; 31(5): 566–571. DOI: 10.1016/j.urolonc.2011.04.001
- Molina R., Filella X., Trapé J., Augé J. M., Barco A., Cañizares F., Colomer A., Fernandez A., Gaspar M. J., Martinez-Peinado A., Pérez L., Sánchez M., Escudero J. M. (2013). “Principales causas de falsos positivos en los resultados de marcadores tumorales en suero.” Sociedad Española de Bioquímica Clínica y Patología Molecular. Comisión de Marcadores Biológicos del Cáncer. PDF
Altres investigacions relacionades
- Abrate, A., et al., Clinical performance of the Prostate Health Index (PHI) for the prediction of prostate cancer in obese men: data from the PROMEtheuS project, a multicentre European prospective study. BJU Int, 2015. 115(4): p. 537-45. PDF
- Abrate, A., G. Lughezzani, G. M. Gadda, G. Lista, E. Kinzikeeva, N. Fossati, A. Larcher, P. Dell’Oglio, F. Mistretta, N. Buffi, G. Guazzoni and M. Lazzeri (2014). “Clinical use of [-2]proPSA (p2PSA) and its derivatives (%p2PSA and Prostate Health Index) for the detection of prostate cancer: a review of the literature.” Korean J Urol 55(7): 436-445. DOI: 10.4111/kju.2014.55.7.436
- Alapont JM, Navarro S, Budía A, España F, Morera F, Jiménez JF. PSA y hK2 en el diagnóstico de cáncer de próstata. Servicio de Urología y *Centro de Investigación. Hospital Universitario La Fe. Valencia – ACTAS UROLÓGICAS ESPAÑOLAS JUNIO 2008. PDF
- BARUTÇUOĞLU, B., et al., Performance of total prostate specific antigen and free prostate specific antigen ratio for screening prostate. Turkish Journal of Cancer. 39, 2009. 1. PDF
- Bo M, Ventura M, Marinello R, Capello S, Casetta G, Fabris F. Relationship between Prostatic Specific Antigen (PSA) and volume of the prostate in the Benign Prostatic Hyperplasia in the elderly. Crit Rev Oncol Hematol. 2003;47(3):207-11. PMID: 12962896
- Cook, B. Prostate cancer diagnostics: now and in the future. 2013. Web
- Duffy, M. J. (2010). “Clinical Utility of Tumor Markers: What the Guidelines Recommend.” Journal of Laboratory Diagnostics 46(3): 281-291. PDF
- Duffy, M. J. and P. McGing (2010). Guidelines for the use of tumour markers. PDF
- Fernández J, Olmo JM, Fernández A, Martín JA, Bermúdez FJ, Pulido E, Molero JM, Morales D. Criterios de derivación en hiperplasia benigna de próstata para atención primaria – Actas Urológicas Españolas – 2010. DOI: 10.1016/S0210-4806(10)70007-3
- Filella X, Giménez N. Evaluation of [− 2] proPSA and Prostate Health Index (phi) for the detection of prostate cancer: a systematic review and meta-analysis, Clinical Chemistry and Laboratory Medicine (CCLM) 2012. DOI: 10.1515/cclm-2012-0410
- Filella X, Foj L, Alcover J, Augé JM, Escudero JM, Molina R. ProPSA, un nuevo biomarcador para la detección y el manejo del cáncer de próstata. Revista del Laboratorio Clínico, 2013. DOI: 10.1016/j.labcli.2013.01.006
- Filella X, Foj L. Emerging biomarkers in the detection and prognosis of prostate cancer. Clinical Chemistry and Laboratory Medicine (CCLM) 2014. DOI: 10.1515/cclm-2014-0988
- Haese A, Graefen M, Noldus J, Hammerer P, Huland E, Huland H. Prostatic volume and ratio of free-to-total prostate specific antigen in patients with prostatic cancer or benign prostatic hyperplasia. J Urol. 1997;158(6):2188-92. PMID: 9366341
- Haese, A. and Partin A.W., Total, Complexed, and Free PSA Forms and Human Glandular Kallikrein 2, in Current Clinical Urology: Management of Prostate Cancer, E.A. Klein, Editor., Humana Press Inc. DOI: 10.1007/978-1-59259-776-5_2
- Hwang, I., et al., The diagnostic ability of an additional midline peripheral zone biopsy in transrectal ultrasonography-guided 12-core prostate biopsy to detect midline prostate cancer. Ultrasonography, 2016. 35(1): p. 61-8. DOI: 10.14366/usg.15039
- Jara Rascón, J., et al., Evaluación del antígeno especifico prostático (PSA) ajustado al volumen de la zona transicional en la detección del cáncer de próstata. Actas Urol Esp, 2005. 29(5). Web
- Malik, G., M. D. Ward, S. K. Gupta, M. W. Trosset, W. E. Grizzle, B. L. Adam, J. I. Diaz and O. J. Semmes (2005). “Serum levels of an isoform of apolipoprotein A-II as a potential marker for prostate cancer.” Clin Cancer Res 11(3): 1073-1085. PMID: 15709174
- Martins A, Reis A, Bovo T, Suaid H, Cologna A, Paschoalin E. Free PSA and prostate volume on the diagnosis of prostate carcinoma – Acta Cirurgica Brasileira – 2003. DOI: 10.1590/S0102-86502003001200008
- Mayeux, R. (2004). “Biomarkers: potential uses and limitations.” NeuroRx 1(2): 182-188. DOI: 10.1602/neurorx.1.2.182
- Medicine, T. A. f. c. B. L. (2013). RECOMMENDATIONS AS A RESULT OF THE ACB NATIONAL AUDIT ON TUMOUR MARKER SERVICE PROVISION. PDF
- Molina, R., et al., Utility of serum tumor markers as an aid in the differential diagnosis of patients with clinical suspicion of cancer and in patients with cancer of unknown primary site. Tumour Biol, 2012. 33(2): p. 463-74. DOI: 10.1007/s13277-011-0275-1
- Nam RK, Diamandis EP, Toi A, et al. Serum human glandular kallikrein-2 protease levels predict the presence of prostate cancer among men with elevated prostate-specific antigen. J Clin Oncol. 2000;18(5):1036-42. DOI: 10.1200/JCO.2000.18.5.1036
- Nickel JC. Benign prostatic hyperplasia: does prostate size matter?. Rev Urol. 2003;5 Suppl 4:S12-7. PMCID: PMC1502356
- Novakovic, S. (2004). “Tumor markers in clinical oncology.” Radiology and Oncology 38(2). PDF
- Ontario Prostate Specific Antigen (PSA) Clinical Guidelines: The PSA Clinical Guideline Expert Committee for the Laboratory Proficiency Testing Program (LPTP), 97.09.30, in Physician Reference Document. 1998. PDF
- Perez, E. O. and M. I. Aceituno Azaustre (2014). “Utilidad clínica de los marcadores tumorales.” Revista Médica de JAÉN(4): 2-12. PDF
- Perkins, G. L., E. D. Slater, G. K. Sanders and J. G. Prichard (2003). “Serum Tumor Markers.” American Family Physician 68(6): 1075 – 1082. PDF
- Punnen, S., N. Pavan and D. J. Parekh (2015). “Finding the Wolf in Sheep’s Clothing: The 4Kscore Is a Novel Blood Test That Can Accurately Identify the Risk of Aggressive Prostate Cancer.” Rev Urol 17(1): 3-13. PMCID: PMC4444768
- Saedi, M. S., Z. Zhu, K. Marker, R. S. Liu, P. M. Carpenter, H. Rittenhouse and S. D. Mikolajczyk (2001). “Human kallikrein 2 (hK2), but not prostate-specific antigen (PSA), rapidly complexes with protease inhibitor 6 (PI-6) released from prostate carcinoma cells.” Int J Cancer 94(4): 558-563. PMID: 11745444
- Salagierski M, Mulders P, Schalken JA. Predicting prostate biopsy outcome using a PCA3-based nomogram in a Polish cohort. Anticancer Res. 2013;33(2):553-7. PMID: 23393348
- Sharma, S. (2009). “Tumor markers in clinical practice: General principles and guidelines.” Indian J Med Paediatr Oncol 30(1): 1-8. PMCID: PMC2902207
- Sikaris, K. PROSTATE HEALTH INDEX. The latest advance in prostate health testing. 2012. DOI: 10.1177/1756287213513488
- Stephan, C., et al., The ratio of prostate-specific antigen (PSA) to prostate volume (PSA density) as a parameter to improve the detection of prostate carcinoma in PSA values in the range of < 4 ng/mL. Cancer, 2005. 104(5): p. 993-1003. DOI: 10.1002/cncr.21267
- Stephan C, Stroebel G, Heinau M, et al. The ratio of prostate-specific antigen (PSA) to prostate volume (PSA density) as a parameter to improve the detection of prostate carcinoma in PSA values in the range of < 4 ng/mL. Cancer. 2005;104(5):993-1003. DOI: 10.1002/cncr.21267
- Sturgeon, C. (2002). “Practice guidelines for tumor marker use in the clinic.” Clin Chem 48(8): 1151-1159. PMID: 12142367
- Sturgeon, C. M., E. P. Diamandis, B. R. Hoffman, D. W. Chan, S. L. Ch’ng, E. Hammond, D. F. Hayes, L. A. Liotta, E. F. Petricoin, M. Schmitt, O. J. Semmes, G. Söletormos and E. van der Merwe (2009). National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for use of tumor markers in clinical practice: quality requirements. DOI: 10.1373/clinchem.2007.094144
- Sturgeon, C. M., B. R. Hoffman, D. W. Chan, S. L. Ch’ng, E. Hammond, D. F. Hayes, L. A. Liotta, E. F. Petricoin, M. Schmitt, O. J. Semmes, G. Soletormos, E. van der Merwe, E. P. Diamandis and B. National Academy of Clinical (2008). “National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for use of tumor markers in clinical practice: quality requirements.” Clin Chem 54(8): e1-e10. DOI: 10.1373/clinchem.2007.094144
- Trapé Pujol, J. and R. Molina Porto (2006). “Aspectos generales de los marcadores tumorales.” JANO 1620: 45-48. PDF
- Zhu, Y., et al., Development and external validation of a prostate health index-based nomogram for predicting prostate cancer. Sci Rep, 2015. 5: p. 15341. DOI: 10.1038/srep15341

