OncoBREAST Dx – Test de diagnòstic per càncer de mama
Visió general
OncoBREAST Dx és una solució innovadora, no invasiva, precisa, rendible i validada, especialment desenvolupada per ajudar en el diagnòstic del càncer de mama així com per a la confirmació de la mateixa ―com a complement a troballes sospitoses obtingudes mitjançant procediments de diagnòstic per la imatge, per tal de reduir el nombre de biòpsies de teixit innecessàries a les que els pacients s’han de sotmetre―. També té usos potencials per a la monitorització del tractament, pronòstic i per a la vigilància davant recidives.
OncoBREAST Dx calcula el risc a partir d’una puntuació que s’obté de diversos biomarcadors del pacient (principalment marcadors tumorals així com de certa informació clínica del mateix).

Click here to download the brochure in PDF format.
Marcadors tumorals
Els marcadors tumorals són substàncies alliberades per les cèl·lules tumorals, que entren al torrent sanguini o altres fluids biològics i són útils per al diagnòstic, pronòstic i monitorització del tractament en diferents tipus de càncer.
La majoria dels marcadors tumorals no són específics de cap tipus de càncer i les diferències entre les malalties benignes i malignes són quantitatives (per exemple, els pacients amb tumors epitelials tendeixen a tenir nivells significativament més alts d’aquests marcadors tumorals que els pacients sense malignitat).
En l’actualitat, existeixen més de 20 paràmetres ben coneguts que són àmpliament considerats com a marcadors de tumors, com el PSA ―relacionat amb el càncer de pròstata―, el CA 15.3 ―relacionat amb el càncer de mama―, el CA 125 i la HE4 ―tots dos relacionats amb càncer de ovari―, el CEA i el CA 19.9 ―ambdós relacionats amb diferents tipus de càncer gastrointestinal (càncer colorectal, gàstric i pancreàtic)―, o la NSE i la ProGRP ―ambdues relacionats amb el càncer de pulmó―.
No obstant això, hi ha una varietat de factors que poden afectar l’exactitud dels marcadors tumorals ja que fan augmentar els seus nivells sense presència de malignitat. La raó principal són les malalties benignes, encara que també poden afectar diferents interferències tècniques.
En aquest sentit, la Societat Espanyola de Bioquímica Clínica i Patologia Molecular, Comissió de Biomarcadors del Càncer, va establir els Criteris Barcelona , 4 criteris que busquen ajudar a distingir i valorar correctament els resultats dels marcadors tumorals i reduir el nombre de falsos positius (FP):
- Avaluació de les concentracions sèriques dels marcadors tumorals.
- Descartar patologies benignes com a principal font de falsos positius.
- Recomanació de seguiment si els marcadors tumorals llancen resultats moderats (Zona Gris/Indeterminat).
- Eliminació d’interferències tècniques.
Mesures estadístiques en proves de diagnòstic
Desafortunadament, l’ús de marcadors tumorals en la rutina presenta també altres problemes, com ara baixa sensibilitat en etapes primerenques o inexistència d’un marcador tumoral específic per a cada tumor maligne. No obstant això, la combinació de 2 o més marcadors tumorals llança millors resultats, especialment en etapes avançades.
En aquest sentit, la combinació de diversos marcadors tumorals ―així com la inclusió d’informació de la història clínica del pacient en els càlculs―, utilitzant algoritmes complexos amb múltiples variables, dóna com a resultat una major sensibilitat i especificitat: això és el que hem batejat com MBDAA (de l’anglès, Multiple Biomarkers Disease Activity Algorithms).
La sensibilitat d’un test de diagnòstic és el percentatge de positius reals que s’identifiquen correctament, i l’especificitat és la proporció de negatius veritables que es classifiquen correctament. Les dues variables estan estretament unides entre si i donen una idea de l’exactitud d’aquest test.
Un test que identifiqui correctament tots els veritables positius com positius, però que tingui molts falsos negatius tindria una sensibilitat del 100%, però una baixa especificitat. Per exemple, la sensibilitat mesura el nombre de tumors malignes que s’identifiquen correctament com càncer, mentre que l’especificitat mesura el nombre de tumors no malignes que s’identifiquen correctament com benignes. Una alta sensibilitat significa menys càncers diagnosticats com benignes i una alta especificitat significa menys tumors benignes diagnosticats com malignes.
A més, el valor predictiu positiu (VPP) és el nombre de veritables positius correctament identificats sobre el total de positius reals. Una prova amb molts falsos positius tindrà un VPP baix. D’altra banda, el valor predictiu negatiu (VPN) és el nombre de negatius veritables correctament identificats sobre el total de negatius reals. Un alt valor VPN vol dir que molt pocs positius veritables van ser incorrectament identificats com negatius.
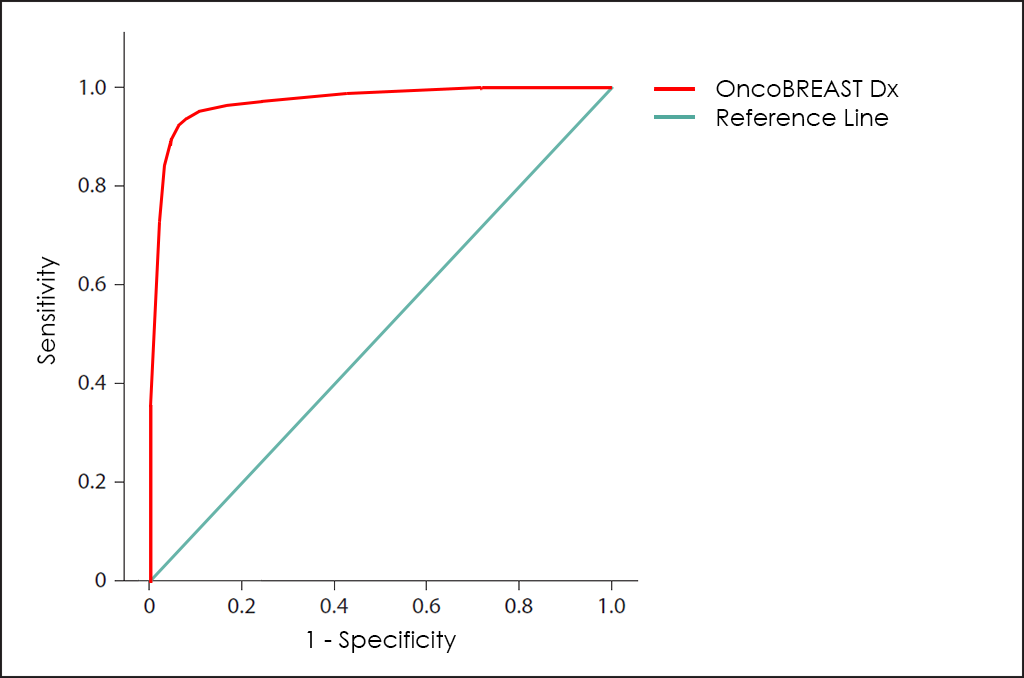
Tots aquests paràmetres diferents es poden representar junts en un gràfic que es coneix com a corba ROC (de l’anglès, Receiving Operator Curve), on es mostren millors resultats amb corbes que tendeixen a acostar-se a la cantonada superior esquerra de la imatge (100% de sensibilitat i 100% d’especificitat).
Corba ROC
La corba ROC del test OncoBREAST Dx ―basat en el recompte combinat dels marcadors tumorals CA 15.3, CEA, EGFR, NSE, NGAL i 8-OHdG; diferents comorbiditats, així com altres dades de 3.655 pacients (ajustats posteriorment mitjançant troballes d’altres investigacions)―, mostra unes capacitats de diagnòstic realment interessants: 91,7% sensibilitat i 93,6% d’especificitat.
Com funciona
Com tots els tests MBDAA de BIOPROGNOS, OncoBREAST Dx està disponible online a través d’un accés segur a la nostra plataforma Cloud. Com a solució al núvol, OncoBREAST Dx està dissenyat per ser utilitzat en modalitat Software as a Service (SaaS), és a dir, sense instal·lació, sense actualitzacions periòdiques, amb baix cost total d’adquisició, així com sense costos de manteniment.
D’aquesta manera, els doctors o els tècnics de laboratori tan sols han d’omplir el formulari online amb els valors obtinguts prèviament dels pacients (dades personals, comorbiditats, valors dels marcadors tumorals, així com la informació d’estil de vida del pacient) i prémer en el botó Enviar per obtenir el risc de tenir càncer de mama.
Fulls de comanda
Per facilitar la feina, els doctors poden descarregar-se i omplir el formulari de comanda del test OncoBREAST Dx d’una manera ràpida i fàcil ―amb totes les dades necessàries per a un càlcul òptim del risc ja detallats―.

Premi aquí per descarregar-se el full de comanda de OncoBREAST Dx en format PDF.
Informe final
Després que els doctors introdueixin les dades del pacient en el formulari online, l’aplicació presenta els resultats en una pantalla separada, permetent la seva conversió a document PDF per descarregar o enviar per correu electrònic.

Premi aquí per descarregar-se l’informe en format PDF.
L’informe inclou dues seccions principals: Informació del pacient i Resultat. En la primera es mostren totes les dades del pacient introduïdes prèviament per al seu seguiment. La segona inclou: Resultats, que indiquen si els nivells dels marcadors tumorals estan dins del rang de normalitat o no; Risc, amb una barra de puntuació que mostra la probabilitat de tenir càncer; Comentaris, creats dinàmicament per ajudar els doctors i als professionals de la salut a entendre d’una manera fàcil com s’han detectat falsos positius (com nivells de marcadors tumorals sospitosos de presència de càncer, però que en considerar les altres variables en conjunt, no es corresponen amb troballes malignes); i, finalment, les Conclusions, amb recomanacions que suggereixen la presència de càncer, repetir el test en 4 setmanes (pel risc moderat, és a dir, aquells casos en què els nivells dels marcadors tumorals són superiors a la normalitat però en els que no està clar ser d’alt risc), o repetir el test en un 1 any per als resultats de baix risc.
Cal tenir en compte que l’informe final està orientat tan sols per a professionals de la salut ―no per pacients―, ja que OncoBREAST Dx ha estat dissenyat com “una eina per ajudar els professionals de la salut en el diagnòstic de càncer”, i certificat amb aquesta finalitat per la DECLARACIÓ DE CONFORMITAT CE (Directiva de Dispositius Metges 93/42/CEE, Classe I, Regla 12).
Declaració de conformidat CE
OncoBREAST Dx posseeix la Declaració de conformitat CE que certifica que ha estat avaluat per complir amb alts requisits de seguretat, salut i protecció ambiental.

Premi aquí per descarregar-se la DECLARACIÓ DE CONFORMITAT CE de OncoBREAST Dx en format PDF.
Aquesta declaració certifica la prova OncoBREAST Dx per tot l’Espai Econòmic Europeu (EEE).
A més, també hi ha altres dos avantatges importants que atorga el marcatge CE, tant a les empreses com als consumidors en l’EEE:
- Les empreses tenen la garantia que els productes que disposen del marcatge CE es poden comercialitzar a tot l’EEE.
- Els consumidors tenen la garantia que es disposa del mateix nivell de salut, seguretat i protecció mediambiental en tot el EEE.
Usos i propòsits d’OncoBREAST Dx
OncoBREAST Dx ha estat desenvolupat per:
- Ajudar en avaluacions diagnòstiques per a pacients d’alt risc (dones amb antecedents familiars de càncer de mama majors de 40 anys, per a les quals el risc es duplica si hi ha un diagnòstic previ d’un familiar de primer grau, o per a les que el risc es quintuplica si hi ha dos familiars de primer grau, així com dones amb mutacions genètiques en els gens BRCA1 o BRCA2, així com el gen CHEK2).
- Dones amb un embalum sospitós al pit.
- Confirmar o descartar malignitat en resultats obtinguts anteriorment amb altres proves, com ara tomografia computada (TC) o imatges de ressonància magnètica (IRM), gràcies a una major sensibilitat i especificitat que els procediments d’imatge, com un mètode complementari per a aquelles pacients amb nivells BI-RADS 3 o 4A (troballes d’imatge sospitoses de càncer de mama que han de ser biopsiades per verificar la malignitat).
- Ajudar als doctors a predir el comportament del càncer i la seva resposta al tractament, així com les possibilitats de recuperació d’una persona.
- Guiar en les decisions de tractament (ajudar a decidir si s’ha d’afegir immunoteràpia després de la cirurgia i/o radioteràpia); monitorització de la teràpia (els doctors poden usar els canvis en la presència o quantitat d’un o més marcadors tumorals per avaluar com el càncer està responent al tractament); així com predir o monitoritzar possibles recidives (la detecció de canvis en els valors dels marcadors tumorals en controls seriats pot ser part del pla de seguiment, el que pot ajudar a detectar una recurrència abans que altres mètodes).
La ciència darrera d’OncoBREAST Dx
Investigacions de referència
- Bayo J., Castaño M. A., Rivera F. and Navarro F. (2017). “Analysis of blood markers for early breast cancer diagnosis”. Clin Transl Oncol. Springer. DOI: 10.1007/s12094-017-1731-1
- Molina R., Filella X., Trapé J., Augé J. M., Barco A., Cañizares F., Colomer A., Fernandez A., Gaspar M. J., Martinez-Peinado A., Pérez L., Sánchez M., Escudero J. M. (2013). “Principales causas de falsos positivos en los resultados de marcadores tumorales en suero”. Sociedad Española de Bioquímica Clínica y Patología Molecular. Comisión de Marcadores Biológicos del Cáncer. PDF
Altres investigacions relacionades
- Asgeirsson K. S., Agrawal A., Allen C., Hitch A., Ellis I. O., Chapman C., Cheung K. L. and Robertson J. F. “Serum epidermal growth factor receptor and HER2 expression in primary and metastatic breast cancer patients”. Breast Cancer Res. 2007;9(6):R75. DOI: 10.1186/bcr1788
- Duffy M.J., Harbeck N., Nap M., Molina R., Nicolini A., Senkus E. and Cardoso F. “Clinical use of biomarkers in breast cancer – Updated Guidelines from the European Group on Tumor Markers (EGTM)”. M.J. Duffy et al. / European Journal of Cancer 75 (2017) 284e298 DOI: 10.1016/j.ejca.2017.01.017
- Kees A. Yedema K. A., Kenemans P., Wobbes T., Van Kamp G. J., De Bruijns H. W., Thomas C. M., Massuger L. F., Schijf C. P., Bon G. G., Vermorken J. B., Voorhorst F. and Hilgers J. (1991). “Carcinoma-Associated Mucin Serum Markers CA M26 and CA M29: Efficacy in Detecting and Monitoring Patients with Cancer of fhe Breast, Colon, Ovary, Endometrium and Cervix”. Int. J . Cancer: 47, 170-179 (1991). Wiley-Liss, Inc. PMID: 1988362
- Ławicki S., Głażewska E. K., Sobolewska M., Będkowska G. E. and Szmitkowski M. (2016). “Plasma Levels and Diagnostic Utility of Macrophage Colony-Stimulating Factor, Matrix Metalloproteinase-9, and Tissue Inhibitor of Metalloproteinases-1 as New Biomarkers of Breast Cancer”. Ann Lab Med. 2016 May;36(3):223229. English. The Korean Society for Laboratory Medicine. DOI: 10.3343/alm.2016.36.3.223
- Ławicki S., Zajkowska M., Głażewska E. K., Szmitkowski M. (2016). “Plasma levels and diagnostic utility of VEGF, MMP-9, and TIMP-1 in the diagnosis of patients with breast cancer”. OncoTargets and Therapy. Dovepress. DOI: 10.2147/OTT.S99959
- Lazarus E., Mainiero M. B., Schepps B., Koelliker S. L. and Livingston L. S. (2006). “BI-RADS Lexicon for US and Mammography: Interobserver Variability and Positive Predictive Value”. Radiology. 2006 May; 239(2):385-91. Epub 2006 Mar 28. DOI: 10.1148/radiol.2392042127
- Martensson J, Bell M, Xu S, Bottai M, Ravn B, Venge P, et al. “Association of plasma neutrophil gelatinase-associated lipocalin (NGAL) with sepsis and acute kidney dysfunction”. Biomarkers. 2013;18:349–56. DOI: 10.3109/1354750X.2013.787460
- Martoni A.,Zamagni C., Bellanova B., Zanichelli L., (1995). “CEA, MCA, CA 15.3 and CA 549 and their combinations in Expressing and Monitoring Metastatic Breast Cancer: a Prospective Comparative Study”. European Journal of Cancer Vol. 31A, No. 10 pp. 1615-1621, 1995. Elsevier Science Ltd. PMID: 7488411
- Mendoza H., Cisneros L., Martin-Ramos J. and Arango J. (2009). “BI-RADS 3. ¿Realmente son hallazgos benignos? Variabilidad interobservador”. Anales de Radiología México 2009;2:173-176. Artículos originales. PDF
- Molina R., Augé J. M., Escudero J. M., Filella X., Zanon G., Pahisa J., Farrus B., Muñoz M., Velasco M. (2010). “Evaluation of tumor markers (HER-2/neu oncoprotein, CEA, and CA 15.3) in patients with locoregional breast cancer: prognostic value”. Tumor Biol. (2010) 31:171–180. DOI 10.1007/s13277-010-0025-9. DOI: 10.1007/s13277-010-0025-9
- Molina R., Augé J. M., Farrus B., Zanon G., Pahisa J., Muñoz M., Torné A., Filella X., Escudero J. M., Fernández P., Velasco M. (2010). “Prospective Evaluation of Carcinoembryonic Antigen (CEA) and Carbohydrate Antigen 15.3 (CA 15.3) in Patients with Primary Locoregional Breast Cancer”. Clinical Chemistry 56:7, 1148–1157 (2010), Cancer Diagnostics. DOI: 10.1373/clinchem.2009.135566
- Molina R., Barak V., van Dalen A., Duffy M. J., Einarsson R., Gion M., Goike H., Lamerz R., Nap M., Sölétormos G. and Stieber P. “Tumor Markers in Breast Cancer – European Group on Tumor Markers (EGTM)”. Tumor Biol 2005 ;26:281–293 DOI: 10.1159/000089260
- Pande D, Negi R, Karki K, Khanna S, Khanna RS, Khanna HD. “Oxidative damage markers as possible discriminatory biomarkers in breast carcinoma”. Transl Res. 2012;160:411–8. DOI: 10.1089/jwh.2016.5973
- Sedgwick E. L., Ebuoma L., Hamame A., Phalak K., Ruiz-Flores L., Ortiz-Perez T. and Sepulveda K. A. (2015). “BI-RADS update for breast cancer caregivers”. Breast Cancer Res Treat (2015) 150:243–254. 3. DOI 10.1007/s10549-015-3332-4
- Tas F, Bilgin E, Karabulut S, Duranyildiz D. “Clinical significance of serum epidermal growth factor receptor (EGFR) levels in patients with breast cancer”. Cytokine. 2015;71:66–70. DOI: 10.1016/j.cyto.2014.09.001
- Valavanidis A, Vlachogianni T, Fiotakis C. “8-hydroxy-2-deoxyguanosine(8-OHdG): a critical biomarker of oxidative stress and carcinogenesis”. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 2009;27:120–39. DOI: 10.1080/10590500902885684
- Wenners AS, Mehta K, Loibl S, Park H, Mueller B, Arnold N, et al. “Neutrophil gelatinase associated lipocalin (NGAL) predicts response to neoadjuvant chemotherapy and clinical outcome in primary human breast cancer”. PLoS One. 2012;7:e45826. DOI: 10.1371/journal.pone.0045826

