OncoLUNG Dx – Test de diagnòstic per càncer de pulmó
Visió general
OncoLUNG Dx és una solució innovadora, no invasiva, precisa, rendible i validada, especialment desenvolupada per ajudar en el diagnòstic del càncer de pulmó, així com per a la confirmació de la mateixa ―com complement a troballes sospitoses obtingudes mitjançant procediments de diagnòstic per la imatge, per tal de reduir el nombre de biòpsies de teixit innecessàries a les que els pacients s’han de sotmetre―. També té usos potencials per a la monitorització del tractament, pronòstic i per a la vigilància davant recidives.
OncoLUNG Dx calcula el risc a partir d’una puntuació que s’obté de diversos biomarcadors del pacient (principalment marcadors tumorals així com de certa informació clínica del mateix).

Click here to download the brochure in PDF format.
Marcadors tumorals
Els marcadors tumorals són substàncies alliberades per les cèl·lules tumorals, que entren al torrent sanguini o altres fluids biològics i són útils per al diagnòstic, pronòstic i monitorització del tractament en diferents tipus de càncer.
La majoria dels marcadors tumorals no són específics de cap tipus de càncer i les diferències entre les malalties benignes i malignes són quantitatives (per exemple, els pacients amb tumors epitelials tendeixen a tenir nivells significativament més alts d’aquests marcadors tumorals que els pacients sense malignitat).
En l’actualitat, existeixen més de 20 paràmetres ben coneguts que són àmpliament considerats com a marcadors de tumors, com el PSA ―relacionat amb el càncer de pròstata―, el CA 15.3 ―relacionat amb el càncer de mama―, el CA 125 i la HE4 ―tots dos relacionats amb càncer de ovari―, el CEA i el CA 19.9 ―ambdós relacionats amb diferents tipus de càncer gastrointestinal (càncer colorectal, gàstric i pancreàtic)―, o la NSE i la ProGRP ―ambdues relacionats amb el càncer de pulmó―.
No obstant això, hi ha una varietat de factors que poden afectar l’exactitud dels marcadors tumorals ja que fan augmentar els seus nivells sense presència de malignitat. La raó principal són les malalties benignes, encara que també poden afectar diferents interferències tècniques.
En aquest sentit, la Societat Espanyola de Bioquímica Clínica i Patologia Molecular, Comissió de Biomarcadors del Càncer, va establir els Criteris Barcelona, 4 criteris que busquen ajudar a distingir i valorar correctament els resultats dels marcadors tumorals i reduir el nombre de falsos positius (FP):
- Avaluació de les concentracions sèriques dels marcadors tumorals.
- Descartar patologies benignes com a principal font de falsos positius.
- Recomanació de seguiment si els marcadors tumorals llancen resultats moderats (Zona Gris/Indeterminat).
- Eliminació d’interferències tècniques.
Mesures estadístiques en proves de diagnòstic
Desafortunadament, l’ús de marcadors tumorals en la rutina presenta també altres problemes, com ara baixa sensibilitat en etapes primerenques o inexistència d’un marcador tumoral específic per a cada tumor maligne. No obstant això, la combinació de 2 o més marcadors tumorals llança millors resultats, especialment en etapes avançades.
En aquest sentit, la combinació de diversos marcadors tumorals ―així com la inclusió d’informació de la història clínica del pacient en els càlculs―, utilitzant algoritmes complexos amb múltiples variables, dóna com a resultat una major sensibilitat i especificitat: això és el que hem batejat com MBDAA (de l’anglès, Multiple Biomarkers Disease Activity Algorithms).
La sensibilitat d’un test de diagnòstic és el percentatge de positius reals que s’identifiquen correctament, i l’especificitat és la proporció de negatius veritables que es classifiquen correctament. Les dues variables estan estretament unides entre si i donen una idea de l’exactitud d’aquest test.
Un test que identifiqui correctament tots els veritables positius com positius, però que tingui molts falsos negatius tindria una sensibilitat del 100%, però una baixa especificitat. Per exemple, la sensibilitat mesura el nombre de tumors malignes que s’identifiquen correctament com càncer, mentre que l’especificitat mesura el nombre de tumors no malignes que s’identifiquen correctament com benignes. Una alta sensibilitat significa menys càncers diagnosticats com benignes i una alta especificitat significa menys tumors benignes diagnosticats com malignes.
A més, el valor predictiu positiu (VPP) és el nombre de veritables positius correctament identificats sobre el total de positius reals. Una prova amb molts falsos positius tindrà un VPP baix. D’altra banda, el valor predictiu negatiu (VPN) és el nombre de negatius veritables correctament identificats sobre el total de negatius reals. Un alt valor VPN vol dir que molt pocs positius veritables van ser incorrectament identificats com negatius.
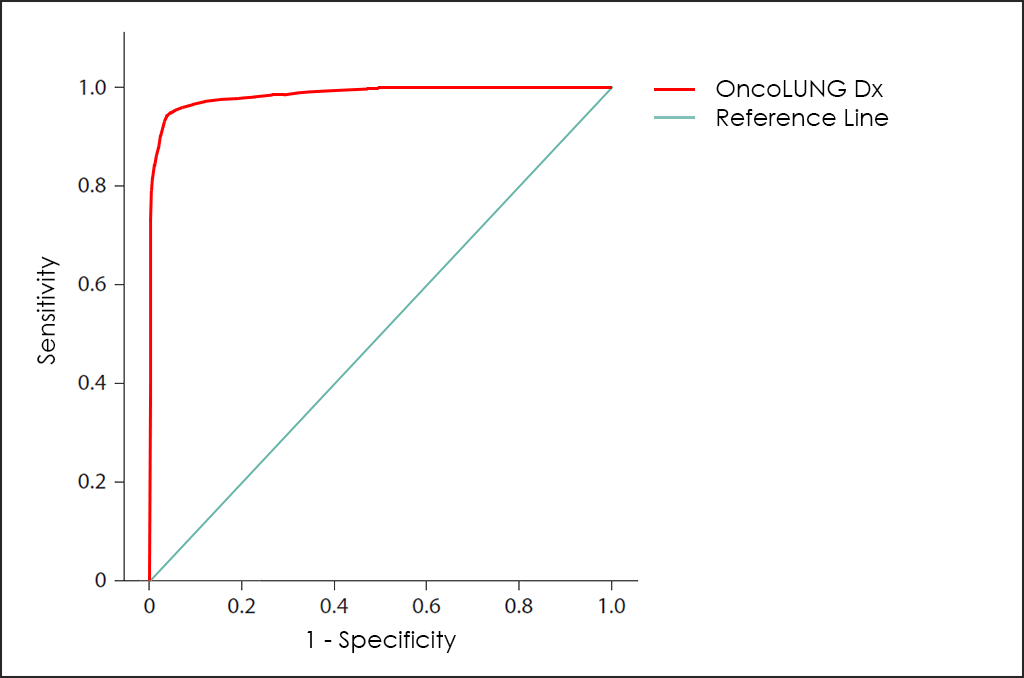
Tots aquests paràmetres diferents es poden representar junts en un gràfic que es coneix com a corba ROC (de l’anglès, Receiving Operator Curve), on es mostren millors resultats amb corbes que tendeixen a acostar-se a la cantonada superior esquerra de la imatge (100% de sensibilitat i 100% d’especificitat).
Corba ROC
La corba ROC del test OncoLUNG Dx ―basat en el recompte combinat dels marcadors tumorals CA 15.3, CEA, CYFRA 21-1, NSE, SCC i ProGRP; diferents comorbiditats; així com altres dades de 4.296 pacients consecutius (ajustats posteriorment mitjançant troballes d’altres investigacions)―, mostra unes capacitats de diagnòstic realment interessants: 93,5% de sensibilitat i 96,2% d’especificitat.
A més del risc: tipus i subtipus histològic
OncoLUNG Dx també permet determinar amb la mateixa precisió el tipus histològic, distingint entre càncer de pulmó de cèl·lules no petites (NSCLC) o càncer de pulmó de cèl·lules petites (SCLC), així com el subtipus, discriminant entre adenocarcinoma o carcinoma de cèl·lules escamoses (en el cas que es tracti d’un NSCLC).
Com funciona
Com tots els tests MBDAA de Bioprognos, OncoLUNG Dx està disponible online a través d’un accés segur a la nostra plataforma Cloud. Com a solució al núvol, OncoLUNG Dx està dissenyat per ser utilitzat en modalitat Software as a Service (SaaS), és a dir, sense instal·lació, sense actualitzacions periòdiques, amb baix cost total d’adquisició, així com sense costos de manteniment.
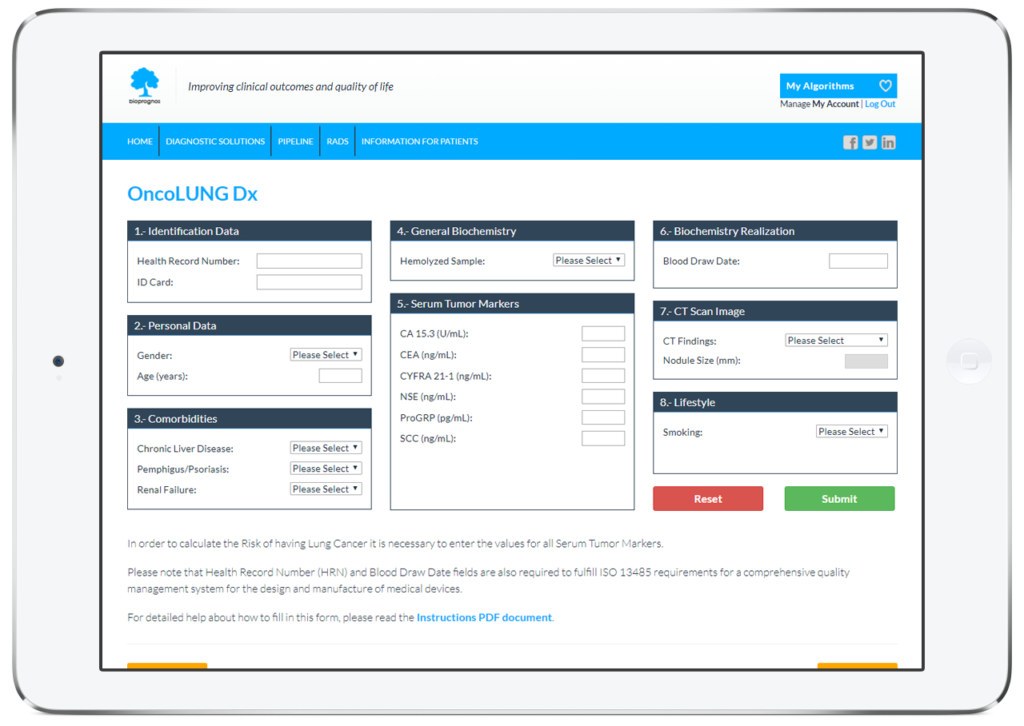
D’aquesta manera, els doctors o els tècnics de laboratori tan sols han d’omplir el formulari online amb els valors obtinguts prèviament dels pacients (dades personals, comorbiditats, valors dels marcadors tumorals, informació d’exploració de la TC, així com la informació d’estil de vida del pacient) i prémer en el botó Enviar per obtenir el risc de tenir càncer de pulmó.
Fulls de comanda
Per facilitar la feina, els doctors poden descarregar-se i re omplir el formulari de comanda del test OncoLUNG Dx d’una manera ràpida i fàcil ―amb totes les dades necessàries per a un càlcul òptim del risc ja detallats―.

Premi aqui per descarregar el Formulari de comanda OncoLUNG Dx en format PDF.
Informe final
Després que els doctors introdueixin les dades del pacient en el formulari online, l’aplicació presenta els resultats en una pantalla separada, permetent la seva conversió a document PDF per descarregar o enviar per correu electrònic.

Premi aqui per descarregar l’informe en format PDF.
L’informe inclou dues seccions principals: Informació del pacient i Resultat. En la primera es mostren totes les dades del pacient introduïdes prèviament per al seu seguiment. La segona inclou: Resultats, que indiquen si els nivells dels marcadors tumorals estan dins del rang de normalitat o no; Risc, amb una barra de puntuació que mostra la probabilitat de tenir càncer de pulmó; Comentaris creats dinàmicament per ajudar els doctors i als professionals de la salut a entendre d’una manera fàcil com s’han detectat falsos positius (com nivells de marcadors tumorals sospitosos de presència de càncer, però que en considerar les altres variables en conjunt, no es corresponen amb troballes malignes); i, finalment, les Conclusions, amb recomanacions que suggereixen la presència de càncer, repetir el test en 4 setmanes (pel risc moderat, és a dir, aquells casos en què els nivells dels marcadors tumorals són superiors a la normalitat però en els que no està clar ser d’alt risc), o repetir el test a 1 any per als resultats de baix risc.
Cal tenir en compte que l’informe final està orientat tan sols per a professionals de la salut ―no per pacients―, ja que OncoLUNG Dx ha estat dissenyat com “una eina per ajudar els professionals de la salut en el diagnòstic de càncer de pulmó”, i certificat amb aquesta finalitat per la DECLARACIÓ dE CONFORMITAT CE (Directiva de Dispositius Metges 93/42/CEE, Classe I, Regla 12).
Declaració de conformitat CE
Des del passat 22 de novembre de 2016 (quan es va llançar la versió 1.0), OncoLUNG Dx posseeix la Declaració de conformitat CE que certifica que ha estat avaluat per complir amb els més alts requisits de seguretat, salut i protecció ambiental.

Premi aquí per descarregar-se la DECLARACIÓ DE CONFORMITAT CE de OncoLUNG Dx en format PDF.
Aquesta declaració certifica la prova OncoLUNG Dx per tot l’Espai Econòmic Europeu (EEE).
A més, també hi ha altres dos avantatges importants que atorga el marcatge CE, tant a les empreses com als consumidors en l’EEE:
- Les empreses tenen la garantia que els productes que disposen del marcatge CE poden comercialitzar a tot el EEE.
- Els consumidors tenen la garantia que es disposa del mateix nivell de salut, seguretat i protecció mediambiental en tot el EEE.
Altres tests disponibles
20/20 GeneSystems, una empresa nord-americana de biotecnologia, ha desenvolupat el test PAULA (de l’anglès, Protein Assays Utilizing Lung Cancer Analytes), un test que incorpora tant antígens tumorals com autoanticossos per determinar el risc de patir càncer de pulmó de cèl·lules no petites (NSCLC).
El test PAULA es basa en 4 biomarcadors trobats en sèrum (CA 125, CEA, CYFRA i NY-ESO-1), i el seu rendiment global és bastant pobre, tal com es pot apreciar a la superposició de les corbes ROC del test PAULA i del nostre test OncoLUNG Dx per a la seva comparació:
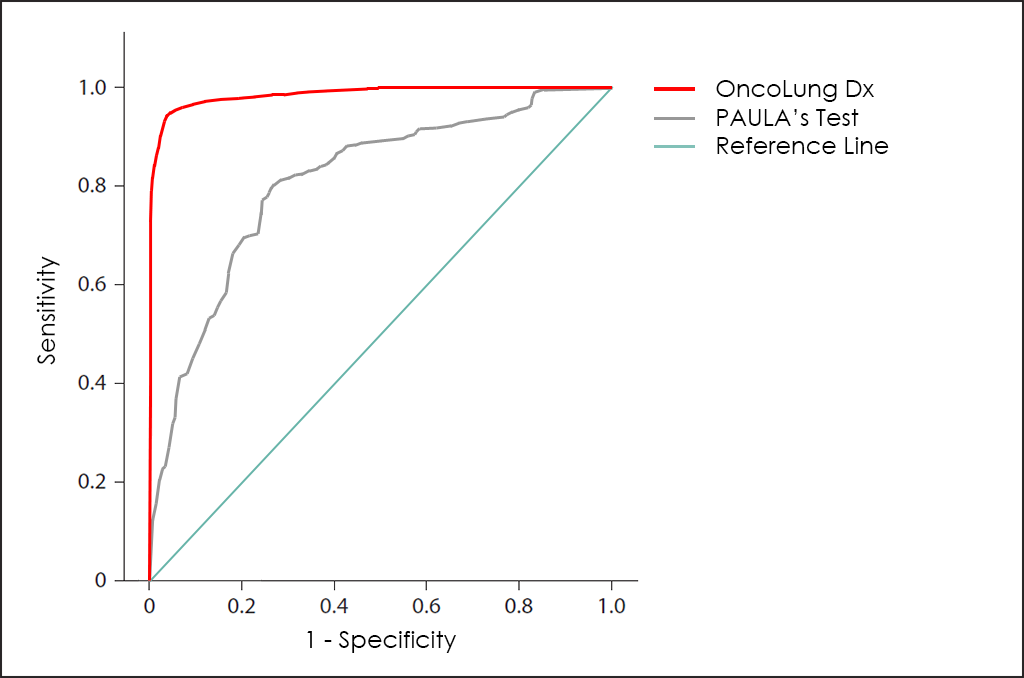
A més, el nostre test OncoLUNG Dx també és capaç de diferenciar entre el càncer de pulmó de cèl·lules no petites (NSCLC) i el càncer de pulmó de cèl·lules petites (SCLC) o neuroendocrí ―una cosa que el test PAULA no pot fer―, així com determinar també el tipus histològic i el subtipus per als NSCLC (diferenciant entre adenocarcinoma i escamós).
Usos i propòsits d’OncoLUNG Dx
OncoLUNG Dx ha estat desenvolupat per:
- Ajuda en avaluacions diagnòstiques per a pacients d’alt risc (fumadors majors de 55 anys).
- Confirmar o descartar malignitat en resultats obtinguts anteriorment amb altres proves, com ara una tomografia computada (TC) o imatges de ressonància magnètica (IRM), gràcies a una major sensibilitat i especificitat que els procediments d’imatge.
- Ajudar als doctors a predir el comportament del càncer i la seva resposta al tractament, així com les possibilitats de recuperació d’una persona.
- Guiar en les decisions de tractament (ajudar a decidir si s’ha d’afegir immunoteràpia després de la cirurgia i/o radioteràpia); monitorització de la teràpia (els doctors poden usar els canvis en la presència o quantitat d’un o més marcadors tumorals per avaluar com el càncer està responent al tractament); així com predir o monitoritzar possibles recidives (la detecció de canvis en els valors dels marcadors tumorals en controls seriats pot ser part del pla de seguiment, el que pot ajudar a detectar una recurrència abans que altres mètodes).
La ciència darrera d’OncoLUNG Dx
Investigacions de referència
- Molina, R., Marrades R. M., Auge J. M., Escudero J. M., Vinolas N., Reguart N., Ramirez J., Filella X., Molins L. and Agusti A. (2016). “Assessment of a Combined Panel of Six Serum Tumor Markers for Lung Cancer.” Am J Respir Crit Care Med 193(4): 427-437. DOI: 10.1164/rccm.201404-0603OC
- Molina R., Filella X., Trapé J., Augé J. M., Barco A., Cañizares F., Colomer A., Fernandez A., Gaspar M. J., Martinez-Peinado A., Pérez L., Sánchez M., Escudero J. M. (2013). “Principales causas de falsos positivos en los resultados de marcadores tumorales en suero.” Sociedad Española de Bioquímica Clínica y Patología Molecular. Comisión de Marcadores Biológicos del Cáncer. PDF
Altres investigacions relacionades
- Black, W. C., I. F. Gareen, S. S. Soneji, J. D. Sicks, E. B. Keeler, D. R. Aberle, A. Naeim, T. R. Church, G. A. Silvestri, J. Gorelick, C. Gatsonis and T. National Lung Screening Trial Research (2014). “Cost-effectiveness of CT screening in the National Lung Screening Trial.” N Engl J Med 371(19): 1793-1802. DOI: 10.1056/NEJMoa1312548
- Chen, F., X. Y. Wang, X. H. Han, H. Wang and J. Qi (2015). “Diagnostic value of Cyfra21-1, SCC and CEA for differentiation of early-stage NSCLC from benign lung disease.” Int J Clin Exp Med 8(7): 11295-11300. PMCID: 26379938
- Doseeva, V., T. Colpitts, G. Gao, J. Woodcock and V. Knezevic (2015). “Performance of a multiplexed dual analyte immunoassay for the early detection of non-small cell lung cancer.” J Transl Med 13Cost-effectiveness of CT screening in the National Lung Screening Trial: 55. PMCID: PMC4335536
- Duffy, M. J. (2010). “Clinical Utility of Tumor Markers: What the Guidelines Recommend.” Journal of Laboratory Diagnostics 46(3): 281-291. PDF
- Duffy, M. J. and P. McGing (2010). Guidelines for the use of Tumour Markers. PDF
- Ferrigno, D., G. Buccheri and C. Giordano (2003). “Neuron-specific enolase is an effective tumour marker in non-small cell lung cancer (NSCLC).” Lung Cancer 41(3): 311-320. PMID: 12928122
- Fuentes, R., I. Bover, J. Rifa, V. Moreno, E. Canals, A. Marquez, E. Barreiro, J. Borras, R. Molina and P. Viladiu (2004). “Factors influencing survival in a prospective cohort of patients with non-small cell lung cancer: an updated assessment.” Clin Oncol (R Coll Radiol) 16(8): 583-584. “DOI: 10.1016/j.clon.2004.08.004“
- Gaspar, M. J., M. Diez, A. Rodriguez, T. Ratia, A. Martin Duce, M. Galvan, J. Granell and C. Coca (2003). “Clinical value of CEA and CA125 regarding relapse and metastasis in resectable non-small cell lung cancer.” Anticancer Res 23(4): 3427-3432.” PMID: 12926084
- Ghosh, I., D. Bhattacharjee, A. K. Das, G. Chakrabarti, A. Dasgupta and S. K. Dey (2013). “Diagnostic Role of Tumour Markers CEA, CA15-3, CA19-9 and CA125 in Lung Cancer.” Indian J Clin Biochem 28(1): 24-29. PMCID: PMC3547445
- Grenier, J., J. L. Pujol, F. Guilleux, J. P. Daures, H. Pujol and F. B. Michel (1994). “Cyfra 21-1, a new marker of lung cancer.” Nucl Med Biol 21(3): 471-476. PMID: 9296767
- Jett, J. R., L. J. Peek, L. Fredericks, W. Jewell, W. W. Pingleton and J. F. Robertson (2014). “Audit of the autoantibody test, EarlyCDT(R)-lung, in 1600 patients: an evaluation of its performance in routine clinical practice.” Lung Cancer 83(1): 51-55. DOI: 10.1016/j.lungcan.2013.10.008
- Korse, C. M., S. Holdenrieder, X. Y. Zhi, X. Zhang, L. Qiu, A. Geistanger, M. R. Lisy, B. Wehnl, D. van den Broek, J. M. Escudero, J. Standop, M. Hu and R. Molina (2015). “Multicenter evaluation of a new progastrin-releasing peptide (ProGRP) immunoassay across Europe and China.” Clin Chim Acta 438: 388-395. DOI: 10.1016/j.cca.2014.09.015
- Lam, S., P. Boyle, G. F. Healey, P. Maddison, L. Peek, A. Murray, C. J. Chapman, J. Allen, W. C. Wood, H. F. Sewell and J. F. Robertson (2011). “EarlyCDT-Lung: an immunobiomarker test as an aid to early detection of lung cancer.” Cancer Prev Res (Phila) 4(7): 1126-1134. DOI: 10.1158/1940-6207.CAPR-10-0328
- Manos, D., J. M. Seely, J. Taylor, J. Borgaonkar, H. C. Roberts and J. R. Mayo (2014). “The Lung Reporting and Data System (LU-RADS): a proposal for computed tomography screening.” Can Assoc Radiol J 65(2): 121-134. DOI: 10.1016/j.carj.2014.03.004
- Masuoka, T., Y. Matueda, H. Ookawa, K. Watanabe and S. Mimoto (1985). “[The measurement of SCC antigen in squamous cell carcinoma of the lung].” Gan No Rinsho 31(8): 914-918. PMID: 4032769
- Mayeux, R. (2004). “Biomarkers: potential uses and limitations.” NeuroRx 1(2): 182-188. DOI: 10.1602/neurorx.1.2.182
- Medicine, T. A. f. c. B. L. (2013). RECOMMENDATIONS AS A RESULT OF THE ACB NATIONAL AUDIT ON TUMOUR MARKER SERVICE PROVISION. PDF
- Molina, R. (2009). “ProGRP: A New Biomarker for Small Cell Lung Cancer.” EUROPEAN JOURNAL OF CLINICAL & MEDICAL ONCOLOGY 1(2): 25-32. DOI: 10.1016/j.clinbiochem.2004.05.007
- Molina, R., J. M. Auge, J. Alicarte, X. Filella, N. Vinolas and A. M. Ballesta (2004). “Pro-gastrin-releasing peptide in patients with benign and malignant diseases.” Tumour Biol 25(1-2): 56-61. DOI: 10.1159/000077724
- Molina, R., J. M. Auge, X. Bosch, J. M. Escudero, N. Vinolas, R. Marrades, J. Ramirez, E. Carcereny and X. Filella (2009). “Usefulness of serum tumor markers, including progastrin-releasing peptide, in patients with lung cancer: correlation with histology.” Tumour Biol 30(3): 121-129. DOI: 10.1159/000224628
- Molina, R., J. M. Auge, J. M. Escudero, R. Marrades, N. Vinolas, E. Carcereny, J. Ramirez and X. Filella (2008). “Mucins CA 125, CA 19.9, CA 15.3 and TAG-72.3 as tumor markers in patients with lung cancer: comparison with CYFRA 21-1, CEA, SCC and NSE.” Tumour Biol 29(6): 371-380. DOI: 10.1159/000181180
- Molina, R., J. M. Auge, X. Filella, N. Vinolas, J. Alicarte, J. M. Domingo and A. M. Ballesta (2005). “Pro-gastrin-releasing peptide (proGRP) in patients with benign and malignant diseases: comparison with CEA, SCC, CYFRA 21-1 and NSE in patients with lung cancer.” Anticancer Res 25(3A): 1773-1778. PMID: 16033098
- Molina, R., X. Bosch, J. M. Auge, X. Filella, J. M. Escudero, V. Molina, M. Sole and A. Lopez-Soto (2012). “Utility of serum tumor markers as an aid in the differential diagnosis of patients with clinical suspicion of cancer and in patients with cancer of unknown primary site.” Tumour Biol 33(2): 463-474. DOI: 10.1007/s13277-011-0275-1
- Molina, R., X. Filella and J. M. Auge (2004). “ProGRP: a new biomarker for small cell lung cancer.” Clin Biochem 37(7): 505-511. DOI: 10.1016/j.clinbiochem.2004.05.007
- Molina, R., X. Filella, J. M. Auge, R. Fuentes, I. Bover, J. Rifa, V. Moreno, E. Canals, N. Vinolas, A. Marquez, E. Barreiro, J. Borras and P. Viladiu (2003). “Tumor markers (CEA, CA 125, CYFRA 21-1, SCC and NSE) in patients with non-small cell lung cancer as an aid in histological diagnosis and prognosis. Comparison with the main clinical and pathological prognostic factors.” Tumour Biol 24(4): 209-218. DOI: 74432
- Molina, R., S. Holdenrieder, J. M. Auge, A. Schalhorn, R. Hatz and P. Stieber (2010). “Diagnostic relevance of circulating biomarkers in patients with lung cancer.” Cancer Biomark 6(3-4): 163-178. DOI: 10.3233/CBM-2009-0127
- Moro, D., D. Villemain, J. P. Vuillez, C. A. Delord and C. Brambilla (1995). “CEA, CYFRA21-1 and SCC in non-small cell lung cancer.” Lung Cancer 13(2): 169-176. PMID: 8581396
- Novakovic, S. (2004). “Tumor markers in clinical oncology.” Radiology and Oncology 38(2). PDF
- Oh, H. J., H. Y. Park, K. H. Kim, C. K. Park, H. J. Shin, J. H. Lim, Y. S. Kwon, I. J. Oh, Y. I. Kim, S. C. Lim, Y. C. Kim, S. H. Kim and M. G. Shin (2016). “Progastrin-releasing peptide as a diagnostic and therapeutic biomarker of small cell lung cancer.” J Thorac Dis 8(9): 2530-2537. DOI: 10.21037/jtd.2016.08.72
- Okamura, K., K. Takayama, M. Izumi, T. Harada, K. Furuyama and Y. Nakanishi (2013). “Diagnostic value of CEA and CYFRA 21-1 tumor markers in primary lung cancer.” Lung Cancer 80(1): 45-49. DOI: 10.1016/j.lungcan.2013.01.002
- Pan, Y. W., Z. G. Zhou, M. Wang, J. Q. Dong, K. P. Du, S. Li, Y. L. Liu, P. J. Lv and J. B. Gao (2016). “Combination of IL-6, IL-10, and MCP-1 with traditional serum tumor markers in lung cancer diagnosis and prognosis.” Genet Mol Res 15(4). DOI: 10.4238/gmr15048949
- Perez, E. O. and M. I. Aceituno Azaustre (2014). “Utilidad clínica de los marcadores tumorales.” Revista Médica de Jaén(4): 2-12. PDF
- Perkins, G. L., E. D. Slater, G. K. Sanders and J. G. Prichard (2003). “Serum Tumor Markers.” American Family Physician 68(6): 1075 – 1082. PDF
- Romero-Ventosa, E. Y., S. Blanco-Prieto, A. L. Gonzalez-Pineiro, F. J. Rodriguez-Berrocal, G. Pineiro-Corrales and M. Paez de la Cadena (2015). “Pretreatment levels of the serum biomarkers CEA, CYFRA 21-1, SCC and the soluble EGFR and its ligands EGF, TGF-alpha, HB-EGF in the prediction of outcome in erlotinib treated non-small-cell lung cancer patients.” Springerplus 4: 171. DOI: 10.1186/s40064-015-0891-0
- Schneider, J., M. Philipp, H. G. Velcovsky, H. Morr and N. Katz (2003). “Pro-gastrin-releasing peptide (ProGRP), neuron specific enolase (NSE), carcinoembryonic antigen (CEA) and cytokeratin 19-fragments (CYFRA 21-1) in patients with lung cancer in comparison to other lung diseases.” Anticancer Res 23(2A): 885-893. PMID: 12820318
- Sharma, S. (2009). “Tumor markers in clinical practice: General principles and guidelines.” Indian J Med Paediatr Oncol 30(1): 1-8. PMCID: PMC2902207
- Song, W. A., X. Liu, X. D. Tian, W. Wang, C. Y. Liang, T. Zhang, J. T. Guo, Y. H. Peng and N. K. Zhou (2011). “Utility of squamous cell carcinoma antigen, carcinoembryonic antigen, Cyfra 21-1 and neuron specific enolase in lung cancer diagnosis: a prospective study from China.” Chin Med J (Engl) 124(20): 3244-3248. PMID: 22088515
- Stieber, P., R. Hatz, S. Holdenrieder, R. Molina, M. Nap, J. von Pawel, A. Schalhorn, J. Schneider and K. Yamaguchi (2006). Practice Guidelines And Recommendations For Use Of Tumor Markers In The Clinic. National Academy of Clinical Biochemistry Guidelines for the use of tumor markers in Lung Cancer. PDF
- Sturgeon, C. (2002). “Practice guidelines for tumor marker use in the clinic.” Clin Chem 48(8): 1151-1159. PMID: 12142367
- Sturgeon, C. M., E. P. Diamandis, B. R. Hoffman, D. W. Chan, S. L. Ch’ng, E. Hammond, D. F. Hayes, L. A. Liotta, E. F. Petricoin, M. Schmitt, O. J. Semmes, G. Söletormos and E. van der Merwe (2009). National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for use of tumor markers in clinical practice: quality requirements. DOI: 10.1373/clinchem.2007.094144
- Sturgeon, C. M., M. J. Duffy, B. R. Hoffman, R. Lamerz, H. A. Fritsche, K. Gaarenstroom, J. M. G. Bonfrer, T. Ecke, H. B. Grossman, P. Hayes, R.-T. Hoffmann, S. P. Lerner, F. Lohe, J. Louhimo, I. Sawczuk, K. Taketa and E. P. Diamandis (2010). USE OF TUMOR MARKERS IN LIVER, BLADDER, CERVICAL, AND GASTRIC CANCERS, The National Academy of Clinical Biochemistry. PDF
- Trape, J., G. Gurt, J. Franquesa, J. Montesinos, A. Arnau, M. Sala, F. Sant, E. Casado, J. M. Ordeig, C. Bergos, F. Vida, P. Sort, A. Isava, M. Gonzalez and R. Molina (2015). “Diagnostic Accuracy of Tumor Markers CYFRA21-1 and CA125 in the Differential Diagnosis of Ascites.” Anticancer Res 35(10): 5655-5660. PMID: 26408739
- Trape, J., R. Molina, F. Sant, J. Montesinos, A. Arnau, J. Franquesa, R. Blavia, E. Martin, E. Marquilles, D. Perich, C. Perez, J. M. Roca, M. Domenech, J. Lopez and J. M. Badal (2012). “Diagnostic accuracy of tumour markers in serous effusions: a validation study.” Tumour Biol 33(5): 1661-1668. DOI: 10.1007/s13277-012-0422-3
- Trapé Pujol, J. and R. Molina Porto (2006). “Aspectos generales de los marcadores tumorales.” JANO 1620: 45-48. PDF
- Vinolas, N., R. Molina, M. C. Galan, F. Casas, M. A. Callejas, X. Filella, J. J. Grau, A. M. Ballesta and J. Estape (1998). “Tumor markers in response monitoring and prognosis of non-small cell lung cancer: preliminary report.” Anticancer Res 18(1B): 631-634. PMID: 9584045
- Yang, D. W., Y. Zhang, Q. Y. Hong, J. Hu, C. Li, B. S. Pan, Q. Wang, F. H. Ding, J. X. Ou, F. L. Liu, D. Zhang, J. B. Zhou, Y. L. Song and C. X. Bai (2015). “Role of a serum-based biomarker panel in the early diagnosis of lung cancer for a cohort of high-risk patients.” Cancer 121 Suppl 17: 3113-3121. DOI: 10.1002/cncr.29551
- Yang-Chun, F., F. Min, Z. Di and H. Yan-Chun (2016). “Retrospective Study to Determine Diagnostic Utility of 6 Commonly Used Lung Cancer Biomarkers Among Han and Uygur Population in Xinjiang Uygur Autonomous Region of People’s Republic of China.” Medicine (Baltimore) 95(18): e3568. DOI: 10.1097/MD.0000000000003568

