OncoLUNG Dx – Test de diagnóstico para cáncer de pulmón
Visión general
OncoLUNG Dx es una solución innovadora, no invasiva, precisa, rentable y validada, especialmente desarrollada para ayudar en el diagnostico del cáncer de pulmón, así como para la confirmación del mismo ―como complemento a hallazgos sospechosos obtenidos mediante procedimientos de diagnóstico por la imagen, con el fin de reducir el número de biopsias de tejido innecesarias a las que los pacientes tienen que someterse―. También tiene usos potenciales para la monitorización del tratamiento, pronóstico así como para la vigilancia ante recidivas.
OncoLUNG Dx calcula el riesgo a partir de una puntuación que se obtiene de varios biomarcadores del paciente (principalmente marcadores tumorales así como de cierta información clínica del mismo).

Click here to download the brochure in PDF format.
Marcadores tumorales
Los marcadores tumorales son sustancias liberadas por las células tumorales, que entran al torrente sanguíneo u otros fluidos biológicos y son útiles para el diagnóstico, pronóstico y monitorización del tratamiento en diferentes tipos de cáncer.
La mayoría de los marcadores tumorales no son específicos de ningún tipo de cáncer y las diferencias entre las enfermedades benignas y malignas son cuantitativas (por ejemplo, los pacientes con tumores epiteliales tienden a tener niveles significativamente más altos de estos marcadores tumorales que los pacientes sin malignidad).
En la actualidad, existen más de 20 parámetros bien conocidos que son ampliamente considerados como marcadores de tumores, como el PSA ―relacionado con el cáncer de próstata―, el CA 15.3 ―relacionado con el cáncer de mama―, el CA 125 y la HE4 ―ambos relacionados con cáncer de ovario―, el CEA y el CA 19.9 ―ambos relacionados con diferentes tipos de cáncer gastrointestinal (cáncer colorrectal, gástrico y pancreático)―, o la NSE y la ProGRP ―ambas relacionados con el cáncer de pulmón―.
Sin embargo, hay una variedad de factores que pueden afectar la exactitud de los marcadores tumorales ya que hacen aumentar sus niveles sin presencia de malignidad. La razón principal son las enfermedades benignas, aunque también pueden afectar diferentes interferencias técnicas.
En este sentido, la Sociedad Española de Bioquímica Clínica y Patología Molecular, Comisión de Biomarcadores del Cáncer, estableció los Criterios Barcelona, 4 criterios que buscan ayudar a distinguir y valorar correctamente los resultados de los marcadores tumorales y reducir el número de falsos positivos (FP):
- Evaluación de las concentraciones séricas de los marcadores tumorales.
- Descarte de patologías benignas como principal fuente de falsos positivos.
- Recomendación de seguimiento si los marcadores tumorales arrojan resultados moderados (Zona Gris/Indeterminado).
- Eliminación de interferencias técnicas.
Mediciones estadísticas en pruebas de diagnóstico
Desafortunadamente, el uso de marcadores tumorales en la rutina presenta también otros problemas, tales como baja sensibilidad en etapas tempranas o inexistencia de un marcador tumoral específico para cada tumor maligno. Sin embargo, la combinación de 2 o más marcadores tumorales arroja mejores resultados, especialmente en etapas avanzadas.
En este sentido, la combinación de varios marcadores tumorales ―así como la inclusión de información de la historia clínica del paciente en los cálculos―, utilizando algoritmos complejos con múltiples variables, da como resultado una mayor sensibilidad y especificidad: eso es lo que hemos bautizado como MBDAA (del inglés, Multiple Biomarkers Disease Activity Algorithms).
La sensibilidad de un test de diagnóstico es el porcentaje de positivos reales que se identifican correctamente, y la especificidad es la proporción de negativos verdaderos que se clasifican correctamente. Ambas variables están estrechamente unidas entre sí y dan una idea de la exactitud de dicho test.
Un test que identifique correctamente todos los verdaderos positivos como positivos, pero que tenga muchos falsos negativos tendría una sensibilidad del 100%, pero una baja especificidad. Por ejemplo, la sensibilidad mide el número de tumores malignos que se identifican correctamente como cáncer, mientras que la especificidad mide el número de tumores no malignos que se identifican correctamente como benignos. Una alta sensibilidad significa menos cánceres diagnosticados como benignos y una alta especificidad significa menos tumores benignos diagnosticados como malignos.
Además, el valor predictivo positivo (VPP) es el número de verdaderos positivos correctamente identificados sobre el total de positivos reales. Una prueba con muchos falsos positivos tendrá un VPP bajo. Por otra parte, el valor predictivo negativo (VPN) es el número de negativos verdaderos correctamente identificados sobre el total de negativos reales. Un alto valor VPN significa que muy pocos positivos verdaderos fueron incorrectamente identificados como negativos.
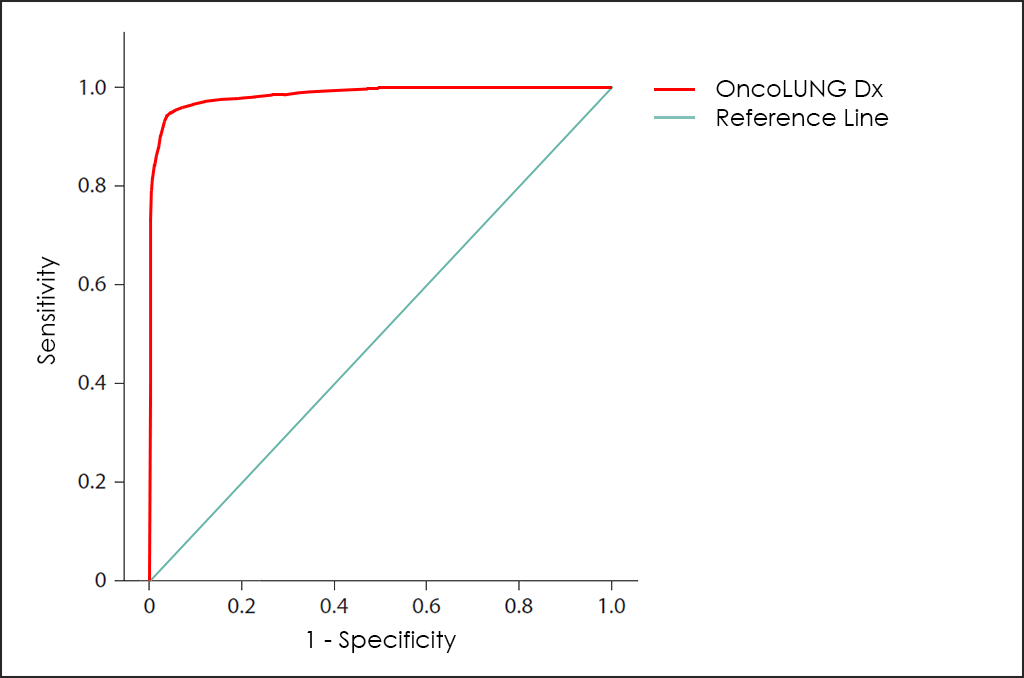
Todos estos parámetros diferentes se pueden representar juntos en un gráfico que se conoce como curva ROC (del inglés, Receiving Operator Curve), donde se muestran mejores resultados con curvas que tienden a acercarse a la esquina superior izquierda de la imagen (100% de sensibilidad y 100% de especificidad).
Curva ROC
La curva ROC del test OncoLUNG Dx ―basado en el recuento combinado de los marcadores tumorales CA 15.3, CEA, CYFRA 21-1, NSE, SCC y ProGRP; diferentes comorbilidades; así como otros datos de 4.296 pacientes consecutivos (ajustados posteriormente mediante hallazgos de otras investigaciones)―, muestra unas capacidades de diagnóstico realmente interesantes: 93,5% de sensibilidad y 96,2% de especificidad.
Además del riesgo: tipo y subtipo histológico
OncoLUNG Dx también permite determinar con la misma precisión el tipo histológico, distinguiendo entre cáncer de pulmón de células no pequeñas (NSCLC) o cáncer de pulmón de células pequeñas (SCLC), así como el subtipo, discriminando entre adenocarcinoma o carcinoma de células escamosas (en el caso que se trate de un NSCLC).
Cómo funciona
Como todos los tests MBDAA de Bioprognos, OncoLUNG Dx está disponible en línea a través de un acceso seguro a nuestra plataforma Cloud. Como solución en la nube, OncoLUNG Dx está diseñado para ser utilizado en modalidad Software as a Service (SaaS), es decir, sin instalación, sin actualizaciones periódicas, con bajo coste total de adquisición, así como sin costes de mantenimiento.
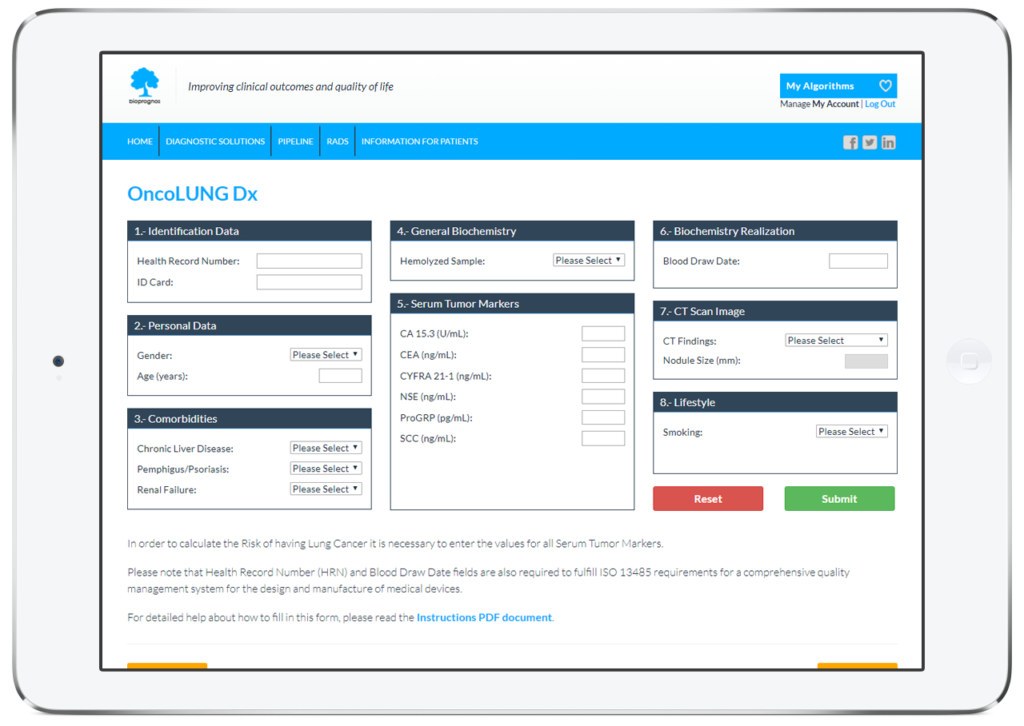
De esta manera, los doctores o los técnicos de laboratorio tan solo deben llenar el formulario online con los valores obtenidos previamente de los pacientes (datos personales, comorbilidades, valores de los marcadores tumorales, información de exploración de la TC, así como la información de estilo de vida del paciente) y pulsar en el botón Enviar para obtener el riesgo de tener cáncer de pulmón.
Hojas de pedido
Para facilitar el trabajo, los doctores pueden descargarse y rellenar el formulario de pedido del test OncoLUNG Dx de una manera rápida y fácil ―con todos los datos necesarios para un cálculo óptimo del riesgo ya detallados―.

Pulse aquí para descargarse la hoja de pedido de OncoLUNG Dx en formato PDF.
Informe final
Después de que los doctores introduzcan los datos del paciente en el formulario online, la aplicación presenta los resultados en una pantalla separada, permitiendo su conversión en documento PDF para ser descargado o enviado por correo electrónico.

Pulse aquí para descargarse el informe en formato PDF.
El informe incluye dos secciones principales: Información del paciente y Resultado. En la primera se muestran todos los datos del paciente introducidos previamente para su seguimiento. La segunda incluye: Resultados, que indican si los niveles de los marcadores tumorales están dentro del rango de normalidad o no; Riesgo, con una barra de puntuación que muestra la probabilidad de tener cáncer de pulmón; Comentarios, creados dinámicamente para ayudar a los doctores y a los profesionales de la salud a entender de una manera fácil cómo se han detectado falsos positivos (como niveles de marcadores tumorales sospechosos de presencia de cáncer, pero que al considerar las otras variables en conjunto, no se corresponden con hallazgos malignos); y, finalmente, las Conclusiones, con recomendaciones que sugieren la presencia de cáncer, repetir el test en 4 semanas (para el riesgo moderado, es decir, aquellos casos en los que los niveles de los marcadores tumorales son superiores a la normalidad pero en los que no está claro ser de alto riesgo), o repetir el test en 1 año para los resultados de bajo riesgo.
Téngase en cuenta que el informe final está orientado tan solo para profesionales de la salud ―no para pacientes―, ya que OncoLUNG Dx ha sido diseñado como “una herramienta para ayudar a los profesionales de la salud en el diagnóstico de cáncer de pulmón”, y certificado con esta finalidad por la DECLARACIÓN DE CONFORMIDAD CE (Directiva de Dispositivos Médicos 93/42/CEE, Clase I, Regla 12).
Declaración de conformidad CE
Desde el pasado 22 de noviembre de 2016 (cuando se lanzó la versión 1.0), OncoLUNG Dx posee la Declaración de Conformidad CE que certifica que ha sido evaluado para cumplir con los más altos requisitos de seguridad, salud y protección ambiental.

Pulse aquí para descargarse la DECLARACIÓN DE CONFORMIDAD CE de OncoLUNG Dx en formato PDF.
Esta declaración certifica la prueba OncoLUNG Dx para todo el Espacio Económico Europeo (EEE).
Además, también hay otras dos ventajas importantes que otorga el marcado CE, tanto a las empresas como a los consumidores en el EEE:
- Las empresas tienen la garantía que los productos que disponen del marcado CE pueden comercializarse en todo el EEE.
- Los consumidores tienen la garantía que se dispone del mismo nivel de salud, seguridad y protección medioambiental en todo el EEE.
Otros tests disponibles
20/20 GeneSystems, una empresa estadounidense de biotecnología, ha desarrollado el test PAULA (del inglés, Protein Assays Utilizing Lung Cancer Analytes), un test que incorpora tanto antígenos tumorales como autoanticuerpos para determinar el riesgo de paceder cáncer de pulmón de células no pequeñas (NSCLC).
El test PAULA se basa en 4 biomarcadores encontrados en suero (CA 125, CEA, CYFRA y NY-ESO-1), y su rendimiento global es bastante pobre, tal como se puede apreciar en la superposición de las curvas ROC del test PAULA y de nuestro test OncoLUNG Dx para su comparación:
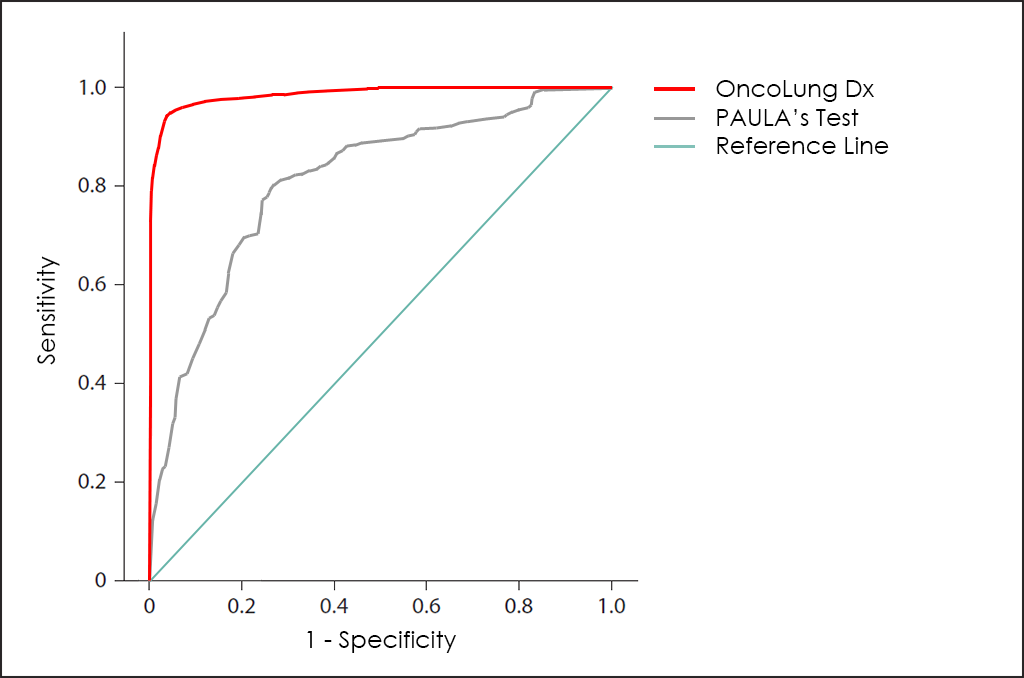
Además, nuestro test OncoLUNG Dx también es capaz de diferenciar entre el cáncer de pulmón de células no pequeñas (NSCLC) y el cáncer de pulmón de células pequeñas (SCLC) o neuroendocrino ―algo que el test PAULA no puede hacer―, así como determinar también el tipo histológico y el subtipo para los NSCLC (diferenciando entre adenocarcinoma y escamoso).
Usos y propósitos de OncoLUNG Dx
OncoLUNG Dx ha sido desarrollado para:
- Ayuda en evaluaciones diagnósticas para pacientes de alto riesgo (fumadores mayores de 55 años).
- Confirmar o descartar malignidad en resultados obtenidos anteriormente con otras pruebas, tales como tomografía computarizada (TC) o imágenes de resonancia magnética (MRI), gracias a una mayor sensibilidad y especificidad que los procedimientos de imagen.
- Ayudar a los doctores a predecir el comportamiento del cáncer y su respuesta al tratamiento, así como las posibilidades de recuperación de una persona.
- Guiar en las decisiones de tratamiento (ayudar a decidir si se debe añadir inmunoterapia después de la cirugía y/o radioterapia); monitorización de la terapia (los doctores pueden usar los cambios en la presencia o cantidad de uno o más marcadores tumorales para evaluar cómo el cáncer está respondiendo al tratamiento); así como predecir o monitorizar posibles recidivas (la detección de cambios en los valores de los marcadores tumorales en controles seriados puede ser parte del plan de seguimiento, lo que puede ayudar a detectar una recurrencia antes que otros métodos).
La ciencia detrás de OncoLUNG Dx
Investigaciones de referencia
- Molina, R., Marrades R. M., Auge J. M., Escudero J. M., Vinolas N., Reguart N., Ramirez J., Filella X., Molins L. and Agusti A. (2016). “Assessment of a Combined Panel of Six Serum Tumor Markers for Lung Cancer.” Am J Respir Crit Care Med 193(4): 427-437. DOI: 10.1164/rccm.201404-0603OC
- Molina R., Filella X., Trapé J., Augé J. M., Barco A., Cañizares F., Colomer A., Fernandez A., Gaspar M. J., Martinez-Peinado A., Pérez L., Sánchez M., Escudero J. M. (2013). “Principales causas de falsos positivos en los resultados de marcadores tumorales en suero.” Sociedad Española de Bioquímica Clínica y Patología Molecular. Comisión de Marcadores Biológicos del Cáncer. PDF
Otras investigaciones relacionadas
- Black, W. C., I. F. Gareen, S. S. Soneji, J. D. Sicks, E. B. Keeler, D. R. Aberle, A. Naeim, T. R. Church, G. A. Silvestri, J. Gorelick, C. Gatsonis and T. National Lung Screening Trial Research (2014). “Cost-effectiveness of CT screening in the National Lung Screening Trial.” N Engl J Med 371(19): 1793-1802. DOI: 10.1056/NEJMoa1312548
- Chen, F., X. Y. Wang, X. H. Han, H. Wang and J. Qi (2015). “Diagnostic value of Cyfra21-1, SCC and CEA for differentiation of early-stage NSCLC from benign lung disease.” Int J Clin Exp Med 8(7): 11295-11300. PMCID: 26379938
- Doseeva, V., T. Colpitts, G. Gao, J. Woodcock and V. Knezevic (2015). “Performance of a multiplexed dual analyte immunoassay for the early detection of non-small cell lung cancer.” J Transl Med 13Cost-effectiveness of CT screening in the National Lung Screening Trial: 55. PMCID: PMC4335536
- Duffy, M. J. (2010). “Clinical Utility of Tumor Markers: What the Guidelines Recommend.” Journal of Laboratory Diagnostics 46(3): 281-291. PDF
- Duffy, M. J. and P. McGing (2010). Guidelines for the use of Tumour Markers. PDF
- Ferrigno, D., G. Buccheri and C. Giordano (2003). “Neuron-specific enolase is an effective tumour marker in non-small cell lung cancer (NSCLC).” Lung Cancer 41(3): 311-320. PMID: 12928122
- Fuentes, R., I. Bover, J. Rifa, V. Moreno, E. Canals, A. Marquez, E. Barreiro, J. Borras, R. Molina and P. Viladiu (2004). “Factors influencing survival in a prospective cohort of patients with non-small cell lung cancer: an updated assessment.” Clin Oncol (R Coll Radiol) 16(8): 583-584. “DOI: 10.1016/j.clon.2004.08.004“
- Gaspar, M. J., M. Diez, A. Rodriguez, T. Ratia, A. Martin Duce, M. Galvan, J. Granell and C. Coca (2003). “Clinical value of CEA and CA125 regarding relapse and metastasis in resectable non-small cell lung cancer.” Anticancer Res 23(4): 3427-3432.” PMID: 12926084
- Ghosh, I., D. Bhattacharjee, A. K. Das, G. Chakrabarti, A. Dasgupta and S. K. Dey (2013). “Diagnostic Role of Tumour Markers CEA, CA15-3, CA19-9 and CA125 in Lung Cancer.” Indian J Clin Biochem 28(1): 24-29. PMCID: PMC3547445
- Grenier, J., J. L. Pujol, F. Guilleux, J. P. Daures, H. Pujol and F. B. Michel (1994). “Cyfra 21-1, a new marker of lung cancer.” Nucl Med Biol 21(3): 471-476. PMID: 9296767
- Jett, J. R., L. J. Peek, L. Fredericks, W. Jewell, W. W. Pingleton and J. F. Robertson (2014). “Audit of the autoantibody test, EarlyCDT(R)-lung, in 1600 patients: an evaluation of its performance in routine clinical practice.” Lung Cancer 83(1): 51-55. DOI: 10.1016/j.lungcan.2013.10.008
- Korse, C. M., S. Holdenrieder, X. Y. Zhi, X. Zhang, L. Qiu, A. Geistanger, M. R. Lisy, B. Wehnl, D. van den Broek, J. M. Escudero, J. Standop, M. Hu and R. Molina (2015). “Multicenter evaluation of a new progastrin-releasing peptide (ProGRP) immunoassay across Europe and China.” Clin Chim Acta 438: 388-395. DOI: 10.1016/j.cca.2014.09.015
- Lam, S., P. Boyle, G. F. Healey, P. Maddison, L. Peek, A. Murray, C. J. Chapman, J. Allen, W. C. Wood, H. F. Sewell and J. F. Robertson (2011). “EarlyCDT-Lung: an immunobiomarker test as an aid to early detection of lung cancer.” Cancer Prev Res (Phila) 4(7): 1126-1134. DOI: 10.1158/1940-6207.CAPR-10-0328
- Manos, D., J. M. Seely, J. Taylor, J. Borgaonkar, H. C. Roberts and J. R. Mayo (2014). “The Lung Reporting and Data System (LU-RADS): a proposal for computed tomography screening.” Can Assoc Radiol J 65(2): 121-134. DOI: 10.1016/j.carj.2014.03.004
- Masuoka, T., Y. Matueda, H. Ookawa, K. Watanabe and S. Mimoto (1985). “[The measurement of SCC antigen in squamous cell carcinoma of the lung].” Gan No Rinsho 31(8): 914-918. PMID: 4032769
- Mayeux, R. (2004). “Biomarkers: potential uses and limitations.” NeuroRx 1(2): 182-188. DOI: 10.1602/neurorx.1.2.182
- Medicine, T. A. f. c. B. L. (2013). RECOMMENDATIONS AS A RESULT OF THE ACB NATIONAL AUDIT ON TUMOUR MARKER SERVICE PROVISION. PDF
- Molina, R. (2009). “ProGRP: A New Biomarker for Small Cell Lung Cancer.” EUROPEAN JOURNAL OF CLINICAL & MEDICAL ONCOLOGY 1(2): 25-32. DOI: 10.1016/j.clinbiochem.2004.05.007
- Molina, R., J. M. Auge, J. Alicarte, X. Filella, N. Vinolas and A. M. Ballesta (2004). “Pro-gastrin-releasing peptide in patients with benign and malignant diseases.” Tumour Biol 25(1-2): 56-61. DOI: 10.1159/000077724
- Molina, R., J. M. Auge, X. Bosch, J. M. Escudero, N. Vinolas, R. Marrades, J. Ramirez, E. Carcereny and X. Filella (2009). “Usefulness of serum tumor markers, including progastrin-releasing peptide, in patients with lung cancer: correlation with histology.” Tumour Biol 30(3): 121-129. DOI: 10.1159/000224628
- Molina, R., J. M. Auge, J. M. Escudero, R. Marrades, N. Vinolas, E. Carcereny, J. Ramirez and X. Filella (2008). “Mucins CA 125, CA 19.9, CA 15.3 and TAG-72.3 as tumor markers in patients with lung cancer: comparison with CYFRA 21-1, CEA, SCC and NSE.” Tumour Biol 29(6): 371-380. DOI: 10.1159/000181180
- Molina, R., J. M. Auge, X. Filella, N. Vinolas, J. Alicarte, J. M. Domingo and A. M. Ballesta (2005). “Pro-gastrin-releasing peptide (proGRP) in patients with benign and malignant diseases: comparison with CEA, SCC, CYFRA 21-1 and NSE in patients with lung cancer.” Anticancer Res 25(3A): 1773-1778. PMID: 16033098
- Molina, R., X. Bosch, J. M. Auge, X. Filella, J. M. Escudero, V. Molina, M. Sole and A. Lopez-Soto (2012). “Utility of serum tumor markers as an aid in the differential diagnosis of patients with clinical suspicion of cancer and in patients with cancer of unknown primary site.” Tumour Biol 33(2): 463-474. DOI: 10.1007/s13277-011-0275-1
- Molina, R., X. Filella and J. M. Auge (2004). “ProGRP: a new biomarker for small cell lung cancer.” Clin Biochem 37(7): 505-511. DOI: 10.1016/j.clinbiochem.2004.05.007
- Molina, R., X. Filella, J. M. Auge, R. Fuentes, I. Bover, J. Rifa, V. Moreno, E. Canals, N. Vinolas, A. Marquez, E. Barreiro, J. Borras and P. Viladiu (2003). “Tumor markers (CEA, CA 125, CYFRA 21-1, SCC and NSE) in patients with non-small cell lung cancer as an aid in histological diagnosis and prognosis. Comparison with the main clinical and pathological prognostic factors.” Tumour Biol 24(4): 209-218. DOI: 74432
- Molina, R., S. Holdenrieder, J. M. Auge, A. Schalhorn, R. Hatz and P. Stieber (2010). “Diagnostic relevance of circulating biomarkers in patients with lung cancer.” Cancer Biomark 6(3-4): 163-178. DOI: 10.3233/CBM-2009-0127
- Moro, D., D. Villemain, J. P. Vuillez, C. A. Delord and C. Brambilla (1995). “CEA, CYFRA21-1 and SCC in non-small cell lung cancer.” Lung Cancer 13(2): 169-176. PMID: 8581396
- Novakovic, S. (2004). “Tumor markers in clinical oncology.” Radiology and Oncology 38(2). PDF
- Oh, H. J., H. Y. Park, K. H. Kim, C. K. Park, H. J. Shin, J. H. Lim, Y. S. Kwon, I. J. Oh, Y. I. Kim, S. C. Lim, Y. C. Kim, S. H. Kim and M. G. Shin (2016). “Progastrin-releasing peptide as a diagnostic and therapeutic biomarker of small cell lung cancer.” J Thorac Dis 8(9): 2530-2537. DOI: 10.21037/jtd.2016.08.72
- Okamura, K., K. Takayama, M. Izumi, T. Harada, K. Furuyama and Y. Nakanishi (2013). “Diagnostic value of CEA and CYFRA 21-1 tumor markers in primary lung cancer.” Lung Cancer 80(1): 45-49. DOI: 10.1016/j.lungcan.2013.01.002
- Pan, Y. W., Z. G. Zhou, M. Wang, J. Q. Dong, K. P. Du, S. Li, Y. L. Liu, P. J. Lv and J. B. Gao (2016). “Combination of IL-6, IL-10, and MCP-1 with traditional serum tumor markers in lung cancer diagnosis and prognosis.” Genet Mol Res 15(4). DOI: 10.4238/gmr15048949
- Perez, E. O. and M. I. Aceituno Azaustre (2014). “Utilidad clínica de los marcadores tumorales.” Revista Médica de Jaén(4): 2-12. PDF
- Perkins, G. L., E. D. Slater, G. K. Sanders and J. G. Prichard (2003). “Serum Tumor Markers.” American Family Physician 68(6): 1075 – 1082. PDF
- Romero-Ventosa, E. Y., S. Blanco-Prieto, A. L. Gonzalez-Pineiro, F. J. Rodriguez-Berrocal, G. Pineiro-Corrales and M. Paez de la Cadena (2015). “Pretreatment levels of the serum biomarkers CEA, CYFRA 21-1, SCC and the soluble EGFR and its ligands EGF, TGF-alpha, HB-EGF in the prediction of outcome in erlotinib treated non-small-cell lung cancer patients.” Springerplus 4: 171. DOI: 10.1186/s40064-015-0891-0
- Schneider, J., M. Philipp, H. G. Velcovsky, H. Morr and N. Katz (2003). “Pro-gastrin-releasing peptide (ProGRP), neuron specific enolase (NSE), carcinoembryonic antigen (CEA) and cytokeratin 19-fragments (CYFRA 21-1) in patients with lung cancer in comparison to other lung diseases.” Anticancer Res 23(2A): 885-893. PMID: 12820318
- Sharma, S. (2009). “Tumor markers in clinical practice: General principles and guidelines.” Indian J Med Paediatr Oncol 30(1): 1-8. PMCID: PMC2902207
- Song, W. A., X. Liu, X. D. Tian, W. Wang, C. Y. Liang, T. Zhang, J. T. Guo, Y. H. Peng and N. K. Zhou (2011). “Utility of squamous cell carcinoma antigen, carcinoembryonic antigen, Cyfra 21-1 and neuron specific enolase in lung cancer diagnosis: a prospective study from China.” Chin Med J (Engl) 124(20): 3244-3248. PMID: 22088515
- Stieber, P., R. Hatz, S. Holdenrieder, R. Molina, M. Nap, J. von Pawel, A. Schalhorn, J. Schneider and K. Yamaguchi (2006). Practice Guidelines And Recommendations For Use Of Tumor Markers In The Clinic. National Academy of Clinical Biochemistry Guidelines for the use of tumor markers in Lung Cancer. PDF
- Sturgeon, C. (2002). “Practice guidelines for tumor marker use in the clinic.” Clin Chem 48(8): 1151-1159. PMID: 12142367
- Sturgeon, C. M., E. P. Diamandis, B. R. Hoffman, D. W. Chan, S. L. Ch’ng, E. Hammond, D. F. Hayes, L. A. Liotta, E. F. Petricoin, M. Schmitt, O. J. Semmes, G. Söletormos and E. van der Merwe (2009). National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for use of tumor markers in clinical practice: quality requirements. DOI: 10.1373/clinchem.2007.094144
- Sturgeon, C. M., M. J. Duffy, B. R. Hoffman, R. Lamerz, H. A. Fritsche, K. Gaarenstroom, J. M. G. Bonfrer, T. Ecke, H. B. Grossman, P. Hayes, R.-T. Hoffmann, S. P. Lerner, F. Lohe, J. Louhimo, I. Sawczuk, K. Taketa and E. P. Diamandis (2010). USE OF TUMOR MARKERS IN LIVER, BLADDER, CERVICAL, AND GASTRIC CANCERS, The National Academy of Clinical Biochemistry. PDF
- Trape, J., G. Gurt, J. Franquesa, J. Montesinos, A. Arnau, M. Sala, F. Sant, E. Casado, J. M. Ordeig, C. Bergos, F. Vida, P. Sort, A. Isava, M. Gonzalez and R. Molina (2015). “Diagnostic Accuracy of Tumor Markers CYFRA21-1 and CA125 in the Differential Diagnosis of Ascites.” Anticancer Res 35(10): 5655-5660. PMID: 26408739
- Trape, J., R. Molina, F. Sant, J. Montesinos, A. Arnau, J. Franquesa, R. Blavia, E. Martin, E. Marquilles, D. Perich, C. Perez, J. M. Roca, M. Domenech, J. Lopez and J. M. Badal (2012). “Diagnostic accuracy of tumour markers in serous effusions: a validation study.” Tumour Biol 33(5): 1661-1668. DOI: 10.1007/s13277-012-0422-3
- Trapé Pujol, J. and R. Molina Porto (2006). “Aspectos generales de los marcadores tumorales.” JANO 1620: 45-48. PDF
- Vinolas, N., R. Molina, M. C. Galan, F. Casas, M. A. Callejas, X. Filella, J. J. Grau, A. M. Ballesta and J. Estape (1998). “Tumor markers in response monitoring and prognosis of non-small cell lung cancer: preliminary report.” Anticancer Res 18(1B): 631-634. PMID: 9584045
- Yang, D. W., Y. Zhang, Q. Y. Hong, J. Hu, C. Li, B. S. Pan, Q. Wang, F. H. Ding, J. X. Ou, F. L. Liu, D. Zhang, J. B. Zhou, Y. L. Song and C. X. Bai (2015). “Role of a serum-based biomarker panel in the early diagnosis of lung cancer for a cohort of high-risk patients.” Cancer 121 Suppl 17: 3113-3121. DOI: 10.1002/cncr.29551
- Yang-Chun, F., F. Min, Z. Di and H. Yan-Chun (2016). “Retrospective Study to Determine Diagnostic Utility of 6 Commonly Used Lung Cancer Biomarkers Among Han and Uygur Population in Xinjiang Uygur Autonomous Region of People’s Republic of China.” Medicine (Baltimore) 95(18): e3568. DOI: 10.1097/MD.0000000000003568

